
题目列表(包括答案和解析)
43].单位时间单位体积内分子碰撞的次数符合公式:Z=2(n‘)2s2 ,求出Z的单位。
,求出Z的单位。
42].温度对反应速率的影响可用阿伦尼乌斯公式的一种形式表示:
式中k1、k2分别为温度T1、T2时某反应的速率常数;E为反应的活化能(单位:kJ/mol)(假定活化能在温度变化范围不大时是常数)。又对同一反应,在不同温度下反应速率常数与反应时间的关系如下:
(1)现知在300K,鲜牛奶5小时后即变酸,但在275K的冰箱里可保存50小时,牛奶变酸反应的活化能是多少?
(2)若鲜牛奶存放2.5小时后即变酸,则此时温度为多少?
C组
41].在敞开容器中,高锰酸钾溶液跟草酸反应时,当把两稀溶液混合后,一小段时间内溶液颜色变化不大,但不久突然褪色。反应的化学方程式:2KMnO4+3H2SO4+5H2C2O4→K2SO4+2MnSO4+10CO2↑+8H2O。据你分析,高锰酸钾溶液紫色突然褪色的原因是什么?
40].已知化学反应为aA+bB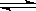 dD+eE,反应物A与B反应生成D和E的反应速率满足公式v=k[A]x[B]y,式中[A]和[B]分别是A、B的浓度,x和y是相应的指数,k是速率常数。对给定的反应,是只是温度的函数,它的单位与x、y数值有关。在HbCO中血红蛋白(Hb)与一氧化碳(CO)的结合力比HbO2中血红蛋白(Hb)与氧气(O2)的结合力大200倍。当空气中的CO浓度达到50 ppm以上,人体就会感到缺氧,这时,血液中羰基血红蛋白(HbCO)达到10%,通常人肺血液中O2的溶解浓度达1.6×10-6mol/L,而其中血红蛋白的浓度稳定在8×10-6mol/L。
dD+eE,反应物A与B反应生成D和E的反应速率满足公式v=k[A]x[B]y,式中[A]和[B]分别是A、B的浓度,x和y是相应的指数,k是速率常数。对给定的反应,是只是温度的函数,它的单位与x、y数值有关。在HbCO中血红蛋白(Hb)与一氧化碳(CO)的结合力比HbO2中血红蛋白(Hb)与氧气(O2)的结合力大200倍。当空气中的CO浓度达到50 ppm以上,人体就会感到缺氧,这时,血液中羰基血红蛋白(HbCO)达到10%,通常人肺血液中O2的溶解浓度达1.6×10-6mol/L,而其中血红蛋白的浓度稳定在8×10-6mol/L。
(1)设速率常数k=2.1×106L/(mol·s)(37℃),求氧血红蛋白(HbO2)的生成速率。
(2)在CO中毒的情况下,需要将HbO2的生成速率提高到1.1×10-4L/(mol·s),试计算这时所需O2的浓度是多少。(假设血液中血红蛋白的浓度恒定),如果血液中氧浓度与进入肺的氧分压成正比,试提出一个实际可行的解决问题的方案。
39].某化学反应2A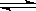 B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)在实验1,反应在10至20min时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
38].以下是著名的碘时钟实验
已知在酸性溶液中,碘酸钾和亚硫酸钠会发生如下一些反应
①IO3-+3HSO3-=3SO42-+3H++I-(慢) ②IO3-+5I-+6H+=3I2+3H2O(慢)
③I2+HSO3-+H2O=2I-+SO42-+3H+(快)
分别配制下面三种溶液。
溶液A:0.9g碘酸钾溶于少量温水中,再稀释到500 mL。
溶液B:0.45g亚硫酸钠配成溶液,稀释到500 mL。
溶液C:取5g可溶性淀粉,放在小烧杯中,加入25 mL冷水,搅拌成悬浊液。另取200mL水加热至沸,趁沸腾时倒入淀粉悬浊液并迅速搅拌,使淀粉糊化、溶解。到溶液冷却后边搅拌边慢慢加入12.5mL浓硫酸,最后也稀释到500mL。
溶液D:200 mL水+50 mLA液+50mL C液
溶液E:225 mL水+25 mLA液+50mL C液
试回答下列问题、
(1)根据实验原理,化学反应速率由那步反应决定 。[填①、②、③]
(2)当哪种离子耗尽时才能见到溶液变蓝色______.(选填:I-、HSO3-、H+、IO3-)
(3)在盛放D液和E液的两只烧杯里同时加入50 mLB液。D、E两烧杯哪个溶液先变蓝色___________(填:D、E)
(4)为研究温度对反应速率的影响准备三份E液(各300 mL,配法同上)、用三支量筒分别量取50mL B液,同时把三份B液分别加入下述不同温度的三份E液中。
a第一份放在石棉网上加热到50℃左右,b第二份维持在室温,c第三份浸在冰水里冷却到近冰点。先变蓝色的是___________。(填:a、b、c)
37].亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
Na2SO3+ KIO3+ H2SO4→ Na2SO4+ K2SO4+ I2+ H2O
(1)配平上面的氧化还原反应方程式,将系数填入方框中。
(2)其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘是 mol。
(3)该反应的过程和机理较复杂,一般认为发生以下①-④反应:
①IO3-+SO32-=IO2-+SO42- (反应速率慢)
②IO2-+2SO32-= I-+2SO42- (反应速率快)
③5I-+6H++ IO3-=3I2+3H2O (反应速率快)
④I2+SO32-+H2O= 2I-+SO42-+2H+ (反应速率快)
根据上述步骤推测该反应总的反应速率由 应应决定(填写上述四步反应的序号)。
(4)若预先加入淀粉溶液,由上述四步反应可以看出必须在 离子消耗完全时,才会有使淀粉变蓝的现象产生。
36].漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为:5HClO2=4ClO2↑+H++Cl-+2H2O。向NaClO2溶液中滴加H2SO4,开始反应缓慢,随后反应迅速,其原因是
A 在酸性条件下亚氯酸的氧化性增强 B 溶液中的H+起催化作用
C ClO2逸出,使反应的生成物降低 D 溶液中的Cl-起催化作用
35].参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的是
A 正反应为吸热的
B 正反应为放热的
C 加入催化剂,该化学反应的反应热不变
D 加入催化剂可增大正反应速率,降低逆反应速率
34].反应A+B→C的反应速率方程式为:v=kc(A)c(B),v为反应速率,k为速率常数。当c(A)=c(B)=1mol/L时,反应速率在数值上等于速率常数。下列说法正确的是
A c(A)增大时,v也增大 B c(B)增大时,k也增大
 C 升高温度时,k值不变 D 升高温度时,v值不变
C 升高温度时,k值不变 D 升高温度时,v值不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com