
题目列表(包括答案和解析)
83].超氧化物歧化酶SOD(本题用E为代号)是生命体中的“清道夫”,在它的催化作用下生命体代谢过程产生的超氧离子才不致过多积存而毒害细胞:
2O2-+2H+ O2+H2O2
O2+H2O2
今在SOD的浓度为co(E)=0.400×10-6mol·L-1,pH=9.1的缓冲溶液中进行动力学研究,在常温下测得不同超氧离子的初始浓度co(O2-)下超氧化物歧化反应的初始反应速率ro如下:
|
co(O2-)/mol·L–1 |
7.69×10- |
3.33×10-5 |
2.00×10-4 |
|
ro/mol·L-1·s-1 |
3.85×10-3 |
1.67×10-2 |
0.100 |
(1)依据测定数据确定歧化反应在常温下的速率方程r=kc(O2-)n的反应级数。
(2)计算歧化反应的速率常数k。要求计算过程。
(3)在确定了上述反应的级数的基础上,有人提出了歧化反应的机理如下:
E+O2-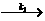 E-+O2 E-+O2-
E-+O2 E-+O2- E+O22-
E+O22-
其中E-为中间物,可视为自由基;过氧离子的质子化是速率极快的反应,可以不予讨论。试由上述反应机理推导出实验得到的速率方程,请明确指出推导过程所作的假设。
(4)设k2=2k1,计算k1和k2。要求计算过程。
82].NO是大气的污染物之一。它催化O3分解,破坏大气臭氧层;在空气中易被氧化为NO2,氮的氧化物参与产生光化学烟雾。空气中NO最高允许含量不超过5mg/L。为此,人们一直在努力寻找高效催化剂,将NO分解为N2和O2。
(1)用热力学理论判断NO在常温、常压下能否自发分解(已知N2、NO和O2的解离焓分别为941.7kJ/mol、631.8kJ/mol和493.7kJ/mol)。
 (2)有研究者用载负Cu的ZSM-5分子筛作催化剂,对NO的催化分解获得了良好效果。实验发现,高温下,当氧分压很小时,Cu/ZSM-5催化剂对NO的催化分解为一级反应;若NO分压相同,在673K和723K时,NO的转化数分别为1.91s-1和5.03s-1(注:转化数为单位时间每个活性中心上NO分解的分子数)。试求NO在该催化剂上分解反应的活化能。
(2)有研究者用载负Cu的ZSM-5分子筛作催化剂,对NO的催化分解获得了良好效果。实验发现,高温下,当氧分压很小时,Cu/ZSM-5催化剂对NO的催化分解为一级反应;若NO分压相同,在673K和723K时,NO的转化数分别为1.91s-1和5.03s-1(注:转化数为单位时间每个活性中心上NO分解的分子数)。试求NO在该催化剂上分解反应的活化能。
(3)考察催化剂的活性常用如右图所示的固定床反应装置。反应气体(NO)由情性载气(He)带入催化剂床层,发生催化反应。设混合气中NO的体积分数为4.0%,混合气流为4.0×10cm3/min(已换算成标准状况),反应管中固体催化剂体积为2.0cm3,表面活性中心(Cu+)含量1.0×10-6mol,反应温度为723K,并设催化剂床层各处反应速率均等。试计算NO分解反应的转化率。
(4)研究者对NO在该催化剂上的分解反应提出如下反应机理:
NO+M NO-M
[1]
NO-M
[1]
2NO-M N2+2O-M [2]
N2+2O-M [2]
2O-M O2+2M(快) [3]
O2+2M(快) [3]
M表示催化剂活性中心,NO为弱吸附,NO-M浓度可忽略。试根据上述机理和M的物料平衡,推导反应的速率方程,并解释当O2分压很低时,总反应表现出一级反应动力学特征。
生物体内重要氧化还原酶大都是金属有机化合物,其中的金属离子不止一种价态,是酶的催化活性中心。研究这些酶的目的在于阐述金属群参与的氧化过程及其电子传递机理,进而实现这些酶的化学模拟。
81].环丙烷的异构化反应可视为理想气体反应,其反应方程式为:
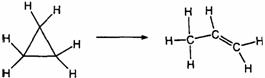
研究表明,在一定压力范围内反应物的半衰期与其初始浓度无关。实验测得半衰期数据为:
800K下半衰期t1/2(800K)=184s,750K下半衰期t1/2(750)=2880s。
(1)求环丙烷异构化反应的表观活化能Ea。
研究者提出环丙烷异构化反应的机理如下:
第一步:环丙烷分子(A)发生碰撞,碰撞分子的能量重新分配,获得能量的环丙烷分子变为活化分子A*:A+A A*+A
A*+A
第二步:活化分子转化为丙烯(B):A* B
B
(2)由上述反应机理推导环丙烷异构化反应的速率方程;讨论反应的初始压力对反应级数的影响。
80].在含有缓冲介质的水溶液中,300K时,研究某无机物A的分解反应:
A(l)→B(g)+H2O(l)
假定气态产物B在水中不溶,有以下实验事实:
(1)固定A溶液上部的体积,在不同时间t下测定产物B气体的分压P,作P-t曲线,可得lgP¥/(P¥-P)=k’t,式中P¥为时间足够长时,A(l)完全分解所产生的B(g)的分压,k’为一常数。
(2)改变缓冲介质,在不同的pH下进行实验,作lg(t1/2/S)-pH图,可得一条斜率为-1,截距为lg{0.693/k}的直线。k为实验速率常数,t1/2的单位为秒(s)。
请回答下列问题:
(1)从上述实验结果出发,试求该反应的实验速率方程。
(2)有人提出如下反应机理:


式中k1,k-1,k2分别为相应基元反应的速率常数,你认为上述反应机理与实验事实是否相符,为什么?
79].环戊二烯(沸点40℃)易于气相中双聚合:2C5H6(g)→C10H12(g)。为了研究这一反应的动力学,将0.50cm3的液态环戊二烯(密度为0.802g/cm3放入事先已抽成真空的1000cm3密闭容器中。
(1)计算当容器升温至130℃时,容器的瞬时起始压强(p0)为多少?(已知相对原子质量:C为12.0,H为1.0)
(2)维持温度在130℃,测得不同时刻的容器总压(p总)如下:
|
t(分) |
10 |
20 |
30 |
40 |
50 |
60 |
|
p总(kPa) |
18.07 |
16.62 |
15.63 |
14.87 |
14.33 |
13.88 |
推导C5H6分压(p1)与p0和p总的函数关系,并计算各时刻的C5H6的分压。
(3)推证该反应的反应级数。
已知对于反应:A→生成物,各简单级数反应的速率公式如下:
零级:c-c0=-kt 一级:lnc=lnc0-kt
二级:1/c=1/c0+kt 三级:1/c2=1/c02+2kt
其中c0为反应物起始浓度,c为t时刻反应物浓度,k为速率常数。
(4)计算反应的速率常数。
(5)计算转化率达80%时所需时间。
78].有化学反应:①A+B 2D ②C+G
2D ②C+G 2H,其中E1、E2为该反应的活化能。
2H,其中E1、E2为该反应的活化能。
(1)vA、vD分别是用物质A、D表示反应①的化学反应速率,则vA与vD的关系为 。
(2)对于反应②,若起始浓度cC=a,cG=2a,cH=0,则用各物质表示的反应速率与时间的关系示意曲线为下图中的 (填序号)。




A B C D
(3)若E1>E2,将两反应的温度分别从500℃升至1000℃,则反应①的速率增加值Δv①与反应②速率的增加值Δv②相比,其关系为 。
77].研究 (i-C3H7O)2POF在不同酸溶液中的水解反应,在一定温度下其一级表现反应常数k只与pH值有关,而与缓冲溶液的种类及浓度无关。当pH值在4-7之间时,k基本上是一常数,当pH值小于4或大于7时k都增加。试解释造成这一现象的原因。
76].气态2一碘代丁烷在碘蒸气中从D型旋光异构体
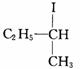 转化到L型旋光异构体反应的速率方程为:速率=kP(A)P(I2)1/2,其中A指D型旋光异构体(在速率方程的表达式中以气体的分压代替浓度是合理的)。试用反应机理来解释速率方程中的分数指数。
转化到L型旋光异构体反应的速率方程为:速率=kP(A)P(I2)1/2,其中A指D型旋光异构体(在速率方程的表达式中以气体的分压代替浓度是合理的)。试用反应机理来解释速率方程中的分数指数。
75].催化剂能够提高下列反应的反应速率:
2NO2+4CO→N2+4CO2 2NO+2CO→N2+2CO2
试说明其具有的重大意义。
74].什么是“可接受”的机理?有没有已证实的机理?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com