
题目列表(包括答案和解析)
21.(15分)氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
□
+□C+□N2 □Si3N4+□CO
□Si3N4+□CO
(1)补充并配平上述反应的化学方程式(填写化学式和化学计量数)。
(2)该反应的平衡常数表达式为K =_______________________;升高温度时平衡常数减小,则其反应热DH________零(填“大于”、“小于”或“等于”);若在一定温度下,当上述反应达到平衡时增加氮气的流量,平衡常数将 (填“增大”、“减小”或“不变”)。
(3)当制得14 g Si3N4时,碳作为 剂将 (填“得到”或“失去”) mol电子,所得的CO为 产物(填氧化或还原); 增加碳的用量时平衡 (填“正向移动”、“逆向移动”或“不移动”)。
(4)氮化硅作为新型材料,具有耐高温、耐腐蚀、抗氧化、耐磨损等优异性能。但作为结构材料,它还存在抗机械冲击强度低、容易发生脆性断裂等缺点。为此工业上常以氮化硅作为基体,加入碳化硅作为添加剂来制造复合材料。以下属于复合材料的是 。
A.玻璃钢 B.钢筋混凝土 C.聚苯乙烯塑料 D.搪瓷
(5)有人曾设想用氧化镁作为制氮化硅时的烧结助剂,此时可能发生的副反应是:
20.(10分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。


请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为______________________________;
X电极上发生的电极反应为____________________________;
(3)当Ag+的消耗速率为0.05mol/(L·min)时,Cu2+的生成速率是 。
(4)铜与盐酸的反应可用于设计原电池吗?简述原因。
19.(9分)蛋白质是一类复杂的含氮化合物,每种蛋白质都有其恒定的含氮量[约在14%~18%(本题涉及的含量均为质量分数)],故食品中蛋白质的含量测定常用凯氏定氮法。其测定原理是:
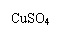 Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4
作用下,生成一种无机含氮化合物,反应式为:
Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4
作用下,生成一种无机含氮化合物,反应式为:
 2NH2-+H2SO4+2H+
2NH2-+H2SO4+2H+
Ⅱ.该无机化合物在凯氏定氮器中与碱作用,通过蒸馏释放出NH3 ,收集于H3BO3 溶液中,生成(NH4)2B4O7。
Ⅲ.用已知浓度的HCl标准溶液滴定,根据HCl消耗的量计算出氮的含量,然后乘以相应的换算系数,即得蛋白质的含量。
(1)上述原理第Ⅰ步生成的无机含氮化合物化学式为 。
(2)上述原理第Ⅱ步有关反应的离子方程式为:
,
(3)乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。不法分子通过在低蛋白含量的奶粉中加入三聚氰胺来“提高”奶粉中的蛋白质含量,导致许多婴幼儿肾结石。
已知三聚氰胺的分子式是C3H6N6,即含氮量为66.7% 。假定奶粉中蛋白质含量为16%即为合格,不法分子在一罐总质量为500g、蛋白质含量为0的假奶粉中掺入 g的三聚氰胺就可使奶粉“达标”。
18、下列叙述中不正确的是
A.在0.1 mol/L CH3COOH溶液中,c(H+)=c(CH3COO-)+c(OH-)
B.常温下将10 mL 0.02 mol/L NaOH溶液与10 mL 0.02 mol/L H2SO4溶液充分混合,
若混合后溶液的体积为20 mL,则混合后溶液的pH=2
C.在0.1 mol/L NH4Cl溶液中,c(H+)=c(NH3·H2O)+c(OH-)
D.在0.1 mol/L Na2CO3溶液中,2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-)
17、为确定某溶液的离子组成,进行如下实验: ①测定溶液的pH,溶液显强碱性。 ②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。 ③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。 ④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。 根据实验以下推测正确的是 A.一定有SO32-离子 B.一定有CO32-离子 C.Cl-离子一定存在 D.不能确定HCO3-离子是否存在
16、在一定条件下,可逆反应:
2X(气)  2Y(气)+Z(气)+Q在t1时刻达到平衡,然后在t2时刻开始加热到一定温度后停止加热并保温,到t3时刻又建立平衡,下图能表示这一变化的是
2Y(气)+Z(气)+Q在t1时刻达到平衡,然后在t2时刻开始加热到一定温度后停止加热并保温,到t3时刻又建立平衡,下图能表示这一变化的是


15、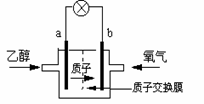 一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍。电池总反应为:
一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍。电池总反应为:
C2H5OH +3O2= 2CO2 +3H2O,电池示意图如图。
下面对这种电池的说法正确的是
A.b极为电池的负极
B.电池工作时电子由a极沿导线经灯泡再到b极
C.电池正极的电极反应为:4H+ +O2 +4e- =2H2O
D.设每个电子所带电量为q库仑,则1mol乙醇被氧化产生6NAq库仑的电量
14、常温下,0.1 mol·L-1某一元酸(HA)溶液中 =1×10-8,下列正确的是
=1×10-8,下列正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.0.1mol/L的NaA溶液中的离子浓度大小关系为:c(Na+)>c(A-) >c(H+)>c(OH-)
C.该溶液中水的离子积常数为1×10-22
D.用0.1 mol·L-1NaOH溶液V1 L 与0.1 mol·L-1该一元酸(HA)V2 L溶液混合,若混合溶液的pH = 7,则V1<V2
13、下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是
|
|
(I) |
(II) |
|
A |
少量SO2通入Ba(OH)2溶液 |
过量SO2通入少量Ba(OH)2溶液 |
|
B |
少量浓氨水滴入Al2(SO4)3溶液 |
少量Al2(SO4)3溶液滴入浓氨水 |
|
C |
0.1mol Cl2通入含0.2mol FeBr2的溶液 |
0.3 molCl2通入0.2molFeBr2溶液中 |
|
D |
过量BaCl2溶液与少量Na2SO4溶液相混合 |
少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
12、已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.含1mol硫酸的稀溶液与含1mo氢氧化钡稀溶液反应放出的热量叫中和热
D.稀盐酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com