
题目列表(包括答案和解析)
14.有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol·L-1,含硝酸的浓度为
1mol·L-,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标况下的气体的体积为
A.89.6mL B.112mL C.168mL D.224mL
第Ⅱ卷(非选择题 共72分)
13.下列实验测量数据记录正确的是
A.用pH试纸测得0.100mol/mol醋酸的pH为3.02
B.用量筒测得排水法收集制得的氢气体为50.28mL
C.用滴定管测得中和滴定所消耗的标准溶液体积为20.32mL
D.用托盘天平称得2.50g胆矾受热充分失水后,固体质量减轻0.90g
12.下列离子方程式书写正确的是
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2+ + OH- + H+ + SO42- == BaSO4↓+ H2O
B.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液
Ca2+ + 2HCO3-+2OH-====CaCO3↓+ 2H2O + CO32-
C.醋酸钡溶液和硫酸反应:Ba2++SO42-== BaSO4↓
D.向酸性FeSO4溶液中加H2O2溶液:
2Fe2+ + 2H2O2 + 4H+ ==2Fe3+ + 4H2O
11.从海水中提取镁,可按如下步骤进行:
① 把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
② 将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。
下列说法不正确的是
A.此法的优点之一是原料来源丰富 B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
10. 设NA表示阿伏加德罗常数,下列叙述中正确的是 :
A.常温常压下,11.2 L氧气所含的原子数为NA
B.1.8 g的 中含有的电子数为NA
中含有的电子数为NA
C.常温常压下,48 g O3含有的氧原子数为3NA
D.常温常压下1 mol NO2气体与水反应生成NA个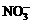 离子
离子
9.在下列实验中,可能达不到目的的是
A.用金属钠与水或乙醇反应,比较水和乙醇分子中羟基氢(-OH)的活泼性 B.用铂(Pt)电极电解Cu(NO3)2 、AgNO3 混合溶液,比较铜和银的金属活泼性 C.检测等物质的量浓度H3PO4和 H2SO4的酸性强弱,比较磷和硫两元素非金属性的强弱.
D.向无色溶液加BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO42-
29. X、Y、Z、W四种元素的原子序数依次增大,且均为短周期元素。X原子最外层电子数是次外层电子数的2倍;Y有两种常见的同素异形体,其中一种是很好的脱色剂和消毒剂。Z、W原子最外层电子数之和是X原子最外层电子数的2倍,这四种元素的原子电子层数之和为10。请填空:
(1)X与Y组成一种有臭味的气体,与氧气按物质的量之比为1:2混合后恰好完全燃烧,生成稳定的氧化物,在同温同压下测得燃烧前后气体的总体积不变,该反应的化学方程式为 。固态的XY2属于 晶体.
(2)若W的单质是有毒气体,则它与强碱溶液反应的离子方程式为
;
由Z和Y可构成具有漂白作用的化合物,其电子式为 。
(3)若W的单质为淡黄色固体,且W与X可形成化合物XW2。
①XW2为 (填“极性”或“非极性”)分子;
②Z的单质在XY2气体中燃烧的现象为
(4)若W的一种单质分子为正四面结构,可用于制造燃烧弹和烟幕弹等。实验室里少量该单质应保存在 中。通常实验室制取Z的最高价氧化物的水化物的离子程式为 。
四川省绵阳南山中学2009届入学考试理科综合
28.有机物A(分子式C6H10O3)是合成某种隐形眼镜材料的单体,A可发生如下变化:
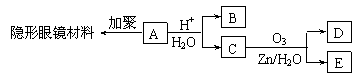 已知:Ⅰ.物质B是最简单的二元醇,可用作汽车发动机抗冻剂;物质D不能发生银镜反应,但能与NaHCO3溶液反应放出气体。
已知:Ⅰ.物质B是最简单的二元醇,可用作汽车发动机抗冻剂;物质D不能发生银镜反应,但能与NaHCO3溶液反应放出气体。
Ⅱ.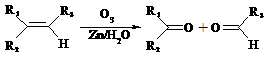
回答下列问题:
⑴隐形眼镜材料的结构简式为 ;
⑵写出物质B在铜催化下与O2反应的化学方程式 ;
⑶与C互为同分异构体,分子为链状的酯类物质共有 种;
⑷请设计合理方案,用物质D制取乙二酸(其他无机原料自选,用反应流程图表示,并注明必要的反应条件)。
例如: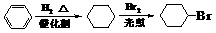
27. 铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的流程如下:
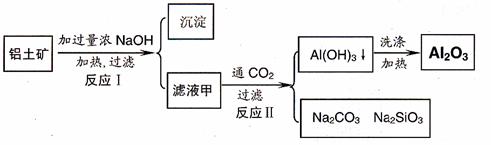
(1)滤液甲的主要成分是
(2)写出反应 II 的离子方程式:
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是 (填字母序号)
a.AlO2-或Al(OH)4- b.OH- C.SiO32-
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀部分消失。写出阴极的电极反应方程式 ,沉淀部分消失的原因可用离子方程式表示为:
(5)取(4)电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol• L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。请画出生成沉淀的物质的量与加入盐酸体积的关系图。
26. 水煤气(主要成分:CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s) + H2O(g) CO (g) + H2 (g);△H = +131.3kJ•mol-1
CO (g) + H2 (g);△H = +131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
V正、V逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
V正=V逆 |
|
II |
0.06 |
0.50 |
0.40 |
? |
|
III |
0.12 |
0.40 |
0.80 |
V正<V逆 |
|
IV |
0.12 |
0.30 |
? |
V正=V逆 |
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充 a mol 炭,水蒸气的转化率将 (填 “增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O), 最终容器中C16O和C18O 的物质的量之比为 。
(3)己知:C (s) + 1/2 O2(g) = CO (g);△H = -110.5kJ·mo1-1
CO(g) + 1/2 O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
H2 (g) + 1/2 O2(g) =H2O (g);△H = -241.8kJ·mo1-1
那么,将2.4 g 炭完全转化为水煤气,然后再燃烧,整个过程△H = kJ·mo1-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com