
题目列表(包括答案和解析)
9. 右图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法正确的是( )
右图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法正确的是( )
A.a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c >b>a
B.d的最高正价与b的最高正价相等
C.b与d不能形成化合物
D.原子半径的大小顺序是c>b>a>d
8.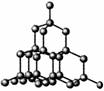 A、B、C、D均为短周期元素。A、B可形成两种液态化合物B2A2、B2A,A与C仅形成两种气态化合物CA、CA2,B可分别与A、C、D形成电子数相等的三种分子X、Y、Z,其中Y的空间结构是正四面体.则下列叙述正确的是( )
A、B、C、D均为短周期元素。A、B可形成两种液态化合物B2A2、B2A,A与C仅形成两种气态化合物CA、CA2,B可分别与A、C、D形成电子数相等的三种分子X、Y、Z,其中Y的空间结构是正四面体.则下列叙述正确的是( )
A.X、Y、Z的稳定性逐渐减弱、熔沸点逐渐升高
B.分子式为D2B4A3的物质水溶液呈碱性
C.自然界中不会存在由A、B、C、D四种元素的组成的化合物
D.A、B、C、D所形成的单质中,有上图所示的一种晶体结构
7.A元素原子的最外层电子数为a。次外层电子数为b;B元素原子的M层上电子数为(a-b),L层上电子数为(a+b).则A、B两元素形成化合物的化学式可表示为( )
A.B3A2 B.BA2 C.A3B2 D.AB2
6.新华网北京2007年1月21日电。“在量子水平上观察到化学反应共振态”当选为2006年中国十大科技进展。中国科学院大连化学物理研究所研究员杨学明和同事首次在实验中观察到了全量子态分辨率的氟化氢分子化学反应的共振现象,并被理论模型所证实。解决了国际上三十多年来化学研究中一个悬而未决的难题,并将化学反应机理的研究推向新的高度和精度.这项研究成果发表在《科学》杂志上。下列不能观察到的是( )
A.H2+F2==2HF,原子重排过程
B.氢气分子断键过程
C.氟化氢分子形成共H-F键的过程
D.氟和氢的原子核中质子运动
5.地球上氦元素主要以4He形式存在且数量较少,而月球土壤中吸附着数百万吨3He,据估算3He核聚变所释放的能量可供人类使用几万年.下列关于3He、4He说法正确的是( )
①3He、4He的化学性质基本相同 ②3He,4He具有相同的中子数
③3He核聚变是化学变化 ④3He液化是物理变化
A.①② B.①④ C.②③ D.③④
4.美国等国家发射的航天器将我国研制的磁谱仪带入太空,其目的是探索反物质。反物质的主要特征是电子带正电荷,质子带负电荷。以下表示反物质酸碱中和反应的通式是( )
A.H-+OH+==H2O B.H++OH+==H2O
C. H-+OH-==H2O D.H++OH-==H2O
3.最近,兰州近代物理研究所研制出我国首批氧-18气体。氧-18是氧的一种同位素,称为重氧,下列说法正确的是( )
A.1.8g氧-18气体的物质的量是0.1mol
B.0.1mol重氧气体的体积是2.24L
C.重氧气体的摩尔质量为36g
D.0.1mol重氧水所含中子数约是6.02 ´1023个
2.已知元素的原子序数,可以推断出原子的( )
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
A.①④⑤ B.②④⑤ C.③④⑤ D.①②③
1.下列分子中,所有原子都满足最外层8电子结构是( )
A.六氟化氙 B.次氯酸 C.五氯化磷 D.白磷
14.(10分)元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数占核外电子总数的3/4,W-、Z+、X+半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素。据此回答下列问题:
(1)A、B均为由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液PH均大于7,组成元素的原子数目比均为1:1:1。若A能抑制水的电离,而B能促进水的电离,则A、B的化学式
(2)用B在碱性条件下可以处理含CN-的工业废水,请将下列6种微粒:
CN-、CO 、N2、OH-、B中阴离子、W的阴离子,分别填入下面对应的横线上,组成一个配平的化学方程式:
、N2、OH-、B中阴离子、W的阴离子,分别填入下面对应的横线上,组成一个配平的化学方程式:
 + + == + + + H2O
+ + == + + + H2O
反应物中发生氧化反应的物质是 ,1mol氧化剂得 mol电子
(3)100gB溶液放置足够长的时间后,其质量变为98.4g。不考虑水的挥发和损失,则原溶液的质量分数是
 15.(14分)下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
15.(14分)下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
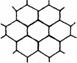



A B C D E
(1)其中代表金刚石的是(填编号字母,下同) ,其中每个碳原子与
个碳原子最接近且距离相等。金刚石属于 晶体。
(2)其中代表石墨的是 ,其中每个正六边形占有的碳原子数平均为 个。
(3)其中表示NaCl的是 ,每个Na+周围与它最接近且距离相等的Na+有 个。
(4)代表CsCl的是 ,它属于 晶体,每个Cs+与 个Cl-紧邻。
(5)代表干冰的是 ,它属于 晶体,每个CO2分子与 个CO2分子紧邻。
(6)上述五种物质熔点由高到低的排列顺序为 。
 16.(10分)核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中:在同周期元素中,Z的金属性最强,Q的非金属性最强;W的单质是自然界存在的黄色固体;X、Y、W在周期表中的相对位置关系如右图所示:
16.(10分)核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中:在同周期元素中,Z的金属性最强,Q的非金属性最强;W的单质是自然界存在的黄色固体;X、Y、W在周期表中的相对位置关系如右图所示:
(1)五种元素形成的单质中常用作强氧化剂的是 、 (填化学式)
(2)这五种元素中,原子半径最大的是 (填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是 (用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序为 (用化学式表示).
(3)Y和Z形成的一种化合物中含有离子键和共价键,写出该化合物与水反应的化学方程式 。
(4)Z与Q反应生成的化合物属于 化合物;电解该化合物的饱和溶液,阳极的电极反应式为 ;电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧生成XY2和液态H2Y时。放出140 kJ的热量.写出该化合物燃烧热的热化学方程式:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com