
题目列表(包括答案和解析)
1.元素的金属性和非金属性与元素在周期表中的递变关系
(1)同周期元素:同周期,电子层数相同,即原子序数越大,原子半径越 ,核对电子的引力越 ,原子失电子能力越 ,得电子能力越 ,金属性越 、非金属性越 。
(2)同主族元素:同主族,电子层数越多原子半径越 核对电子引力越 原子失电子能力越强得电子能力越弱金属性越 、非金属性越 。
2、硅、磷、硫、氯的非金属性的递变规律
|
|
Si |
P |
S |
Cl |
|
最高正价 |
|
|
|
|
|
最低负价 |
|
|
|
|
|
单质与氢气反应的条件及氢化物稳定性 |
|
|
|
|
|
最高价氧化物 |
|
|
|
|
|
离高价氧化物的水化物 |
H4SiO4 弱酸 |
H3PO4 中强酸 |
H2SO4 强酸 |
HClO4 最强无机酸 |
 酸性逐渐增强 酸性逐渐增强 |
||||
|
结论 |
|
综上所述,我们可以从11-18号元素性质的变化中得出如下结论:
Na Mg Al Si P S Cl Ar
 金属性逐渐减弱,非金属性逐渐增强 稀有气体元素
金属性逐渐减弱,非金属性逐渐增强 稀有气体元素
金属性的判断:①单质与水反应置换出氢的难易程度;②单质与酸反应置换出氢的难易程度③最高价氧化物对应的水化物(氢氧化物)的碱性强弱。
非金属性的判断:①与氢气反应生成氢化物的难易程度;②氢化物的稳定性;③最高价氧化物对的水化物的酸性强弱。
1、探究第三周期元素性质递变规律:
(1)钠镁铝金属性的递变规律
①与水反应:Mg常温下与水无明显现象;加热镁带表面有大量气泡出现,滴入酚酞溶液变红。Al在常温或加热下,遇水无明显现象。
②与酸反应:Mg与盐酸反应要比Al剧烈。与Mg反应的试管壁温度_,与Al反应的试管壁温度_。
③Na2O、MgO为碱性氧化物,Al2O3为两性氧化物。Al(OH)3为两性两性氢氧化物。
_Al2O3+_HCl = __+__ ; _Al2O3+_NaOH = ___+___。
_Al(OH)3+_H2SO4 == __+__; _Al(OH)3+_NaOH =__+___。
3.元素性质原子核外电子排布的关系
(1)稀有气体元素的原子最外层有8个电子(He为2)处于稳定结构,化学性质稳定,一般不跟其它物质发生化学反应。
(2)非金属性与金属性(一般规律):
|
|
电外层电子数 |
得失电子趋势 |
元素性质 |
|
金属元素 |
<4 |
__ |
___ |
|
非金属元素 |
>4 |
__ |
___ |
2.核外电子排布规律
电子由内向外按能量由低到高分层排布,第n层最多容纳的电子数为__,最外层电子数≤_。(K层为最外层不超过_个)。次外层电子数≤__,倒数第三层电子数≤__。
1.核外电子运动特征:(1)核外电子的特征:⑴电子的质量极___(____kg);
⑵电子绕核运动是在_______的空间(原子的直径约___m)中进行;⑶电子绕核作__速运动(运动的速度接近__,约为__)。
(3)核外电子运动特征:电子绕核运动__确定的轨道,__精确测定或计算电子在任一时刻所在的位置,____描绘出其运动轨迹。我们只能指出___________。
(3)电子层与离核远近及能量高低关系:
|
层序数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
电子层符号 |
K |
L |
M |
N |
O |
P |
Q |
|
离核远近 |
|
||||||
|
能量 |
|
21.(2006上海23,A)
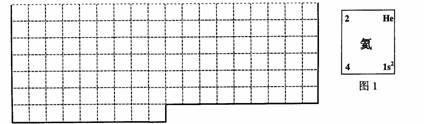
(1)上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界。
(2)元素甲是第三周期ⅥA族元素,请在右边方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。

(3)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:___>___。
甲、乙的最高价氧化物水化物的酸性强弱为:________>________(用化学式表示)。
(4)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表中的位置与元素原子结构的关系:________________。
20.有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷数总和为38。Y元
素原子最外层电子数占核外总电子数的3/4;W元素原子最外层电子比同周期Z元素多5个电子;W和Y不属同一主族。
(1)写出元素符号:X__________,Y___________,Z__________,W___________。
(2)Z、W两元素最高价氧化物对应水化物反应的方程式是 。
(3)把Z的单质(片状)放入滴有酚酞的沸水中,观察到的现象是____________,反应的
化学方程式是_________________________________________。
19.1971年美国的斯图杰尔和阿佩里曼在0℃ 以下将氟气从细冰末上通过,成功地合
成了一直认为不存在的氟的含氧酸--次氟酸。
(1)写出次氟酸的结构并指出各元素的化合价__________________;
(2)次氟酸刹那间被热水分解得到既可表现氧化性 (对NaI)又可表现还原性(对KMnO4)的溶液,写出反应的化学方程式_______________________________。
18.1999年是人造元素丰收年,一年间得到第114、116和118号三个新元素。按已知
的原子结构规律,118号元素应是第________周期第_________族元素,它的单质在常温常压下最可能呈现的状态是__________(气、液、固选一填入)。近日传闻俄罗斯合成了第166号元素,若已知原子结构规律不变,该元素应是第_________周期第________元素。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com