
题目列表(包括答案和解析)
4.人体每天必须摄人一定量的蛋白质,婴幼儿每天的食物中蛋白质摄人比例应比成年人 高。下列理由不正确的是 ( )
A.蛋白质和氨基酸不能在人体内大量、长期储存
B.蛋白质是主要的能源物质,每天都有大量的被分解供能
C.组织蛋白等自身蛋白质每时每刻都在“降解更新”
D.婴幼儿生长发育快,要产生很多的新细胞,而蛋白质是构成细胞和生物体的重要物质
3.下列物质或结构中含胸腺嘧啶“T”的是 ( )
A.DNA聚合酶 B.烟草花叶病毒
C.ATP D.B淋巴细胞中的线粒体
2.为了确定某种矿质元素是否是植物的必需元素,应采用的方法是 ( )
A.检测正常叶片中该矿质元素的含量
B.分析根系对该矿质元素的吸收过程
C.分析环境条件对该矿质元素吸收的影响
D.观察含全部营养的培养液中去掉该矿质元素前、后植株生长发育状况
1.下列生物学研究方法中,不正确的是 ( )
A.利用纸层析法分离叶绿体中的色素
B.利用同位素示踪法研究光合作用碳原子的转移途径
C.利用取样调查法研究生物的种群密度
D.利用饲喂法研究生长激素的生理作用
22、(10分)H2还原CuO反应不完全时,得到Cu、CuO、Cu2O的固体混和物,某化学兴趣小组同学为探究上述固体的成分进行了如下实验:
(1)取一定量的均匀固体混合物A,将其分成两等份。
(2)取其中一份用足量的H2还原,测得反应后固体质量减少3.20g。
(3)另一份加入500mL稀HNO3,固体恰好完全溶解,同时收集到标况下NO气体为2.24L。请回答下列问题:
(1)A中n(Cu)+n(Cu2O)= 。
(2) A中n(CuO)的取值范围是 。
(3)试计算所用稀HNO3的物质的量浓度。
21、(10分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。

(1)写出A、B的化学式A B
(2)写出下列化学反应方程式:
反应②的化学方程式 ;
反应③的化学方程式 ;
反应⑤的离子方程式 。
20、 (12分)碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。
(12分)碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
9.8 |
|
物质 |
MnS |
CuS |
PbS |
|
Ksp |
2.5×10-13 |
6.3×10-36 |
8.0×10-28 |
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气。流程①中主要发生的反应有:MnO2 + SO2 = MnSO4 2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42-+ 4H+。
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH (填“大”或“小”),该流程可与 (填工业生产名称)联合,生产效益更高。
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为
,这样设计的目的和原理是 。
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是
。
(4)反应④发生的化学反应为:MnSO4 + 2NH4HCO3 = MnCO3↓+ (NH4)2SO4 + CO2↑ + H2O。
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8-7.4。加入稍过量的NH4HCO3的目的是 ,溶液的pH不能过低的原因是 。
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤碳粉混合,焙烧后加稀硫酸溶解。
其中工艺A的优点是 。(答对1个即可)
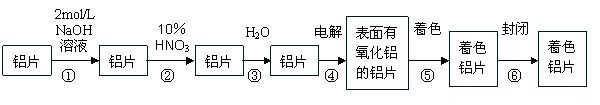
19、(11分)生产着色铝片的工艺流程如下:
 请回答下列问题:
请回答下列问题:
(1)第①步中NaOH溶液的作用是 。
(2)第②步HNO3的作用是对铝片进行抛光,写出其反应的的离子方程式
。
(3)在第④步电解是以铝片为电极,在硫酸介质中控制电压电流,使阳极的铝表面形成一层致密的氧化膜(α-Al2O3,该氧化膜不溶于酸)。写出有关的电极反应式:
阴极: 阳极:
(4)氧化膜质量的检验:取出铝片干燥,在氧化膜未经处理的铝片上分别滴一滴氧化膜质量检查液(3gK2CrO4+75mL水+25mL浓盐酸),判断氧化膜质量的依据是 。
A、铝片表面有无光滑 B、比较颜色变化 C、比较质量大小 D、比较反应速率大小
(5)将已着色的铝干燥后在水蒸气中进行封闭处理约20-30min,封闭的目的是使着色的
氧化膜更加致密,有关反应化学方程式是 。
18、(10分)现有NaOH固体、大理石、蒸馏水和盐酸,需制取33g纯NaHCO3。请参照物质的溶解度表回答有关问题:
|
溶质 |
NaOH |
NaHCO3 |
Na2CO3 |
|
25ºC时溶解度(g/100g水) |
110 |
9 |
30 |
(1)制取过程中反应的化学方程式为 、
;
(2)若提供100g水,则需NaOH的物质的量为 。
(3)简述实验的操作过程:(产生CO2操作不用写)
① ,
② ,
③ ,
④ 。
17、(11分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
 请根据上面叙述,回答:
请根据上面叙述,回答:
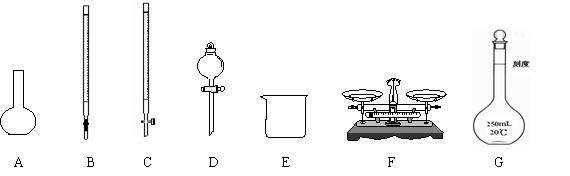
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
(2)写出步骤③中发生反应的离子方程式 。
(3)洗涤沉淀的操作是 。
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是
。
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数
为 。(列出算式,不需化简)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com