
题目列表(包括答案和解析)
3.考试结束,监考人将本试卷和答题卡一并收回。
相对原子质量:H-l C一12 O-16 P一31 S- 32 Na -23 Ca一40
本卷共22题,每题2分。共44分。每题只有一个选项符合题意。
2.第Ⅰ卷每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如
需改动,用橡皮擦干净后,再选涂其他答案。不能答在试卷上。
21、今年5月12日14时28分,我国四川省汶川发生特大地震,给人民的生产生活带来了具大灾难。过氧乙酸(CH3COOOH)是震区防疫消毒广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c1,涉及下列反应:
① ___MnO4-+___H2O2+____H+ ===____Mn2++____O2十_____H2O
② H2O2+2 +2H+=== I2+2H2O
+2H+=== I2+2H2O
③ CH3COOOH+2 +2H+=== CH3COOH+I2+H2O
+2H+=== CH3COOH+I2+H2O
④ I2 + 2S2O32- === 2I- + S4O62-
请回答以下问题:
⑴配平反应①的离子方程式并标出电子转移情况:
MnO4-+ H2O2+ H+ === Mn2++ O2十 H2O
⑵用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________。
⑶取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol· 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成
I2(反应②和③)。再用浓度为a2 mol· 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2
mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2
mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= 。
⑷为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)。
18(每空3分,共12分)有A、B、C、D四种可溶性离子化合物,它们的阳离子分别是Ag+、Na+、Ba2+、Cu2+,阴离子是Cl-、OH-、NO 、SO
、SO (每种离子只能用一次),现将溶液两两混合,记录现象如下:
(每种离子只能用一次),现将溶液两两混合,记录现象如下:
A+B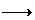 白色沉淀,A+C
白色沉淀,A+C 白色沉淀,B+C
白色沉淀,B+C 白色沉淀
白色沉淀
B+D 无明显现象,A+D
无明显现象,A+D 白色沉淀(瞬间又转变成灰黑色)
白色沉淀(瞬间又转变成灰黑色)
C+D 蓝色沉淀。
蓝色沉淀。
已知Ag2SO4是微溶性白色沉淀,AgOH为白色沉淀但很不稳定容易分解生成灰黑色的Ag2O,则A、B、C、D的化学式分别是________、________、________、________。
19(每空2分,共12分)X、Y是中学化学里常用的物质,其中Y是单质,X是化合物;它们之间相互反应以及生成物之间的关系如下图所示:

已知E溶液跟NH4SCN的稀溶液混合时,溶液呈血红色。请回答:
(1)Y和X浓溶液反应的条件是 ,而常温下难反应的原因是 。
(2)写出F和G相互转化的化学方程式:
F→G+X G→F
(3)L转化成I的现象是 ,有关的化学方程式是 。
20(每空3分,共12分)、近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
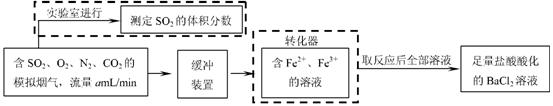
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是 。
A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,欲测定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
17、三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 )
。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出发生反应的离子方程式 、
、 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4) 实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
16、今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,分别取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.K+一定存在 B.Cl-一定存在
C.100mL溶液中含0.01mol CO32- D. Ba2+一定不存在,Mg2+可能存在
第Ⅱ卷(本卷共64分)
15、1mol过氧化钠与1mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.Na2CO3 B.Na2O2 Na2CO3
C.NaOH Na2CO3 D.Na2O2 NaOH Na2CO3
14、某学生在实验室做了5个实验:
(1)在铝盐溶液中逐滴加入稀氨水直至过量,(2)在明矾溶液中加入NaOH溶液直至过量,(3)在强碱性溶液中逐滴加入铝盐溶液直至过量,(4)在偏铝酸钠溶液中通入CO2直至过量,(5)在强酸溶液中逐滴加入偏铝酸钠溶液直至过量。
并根据以上实验画出下列5种图象(纵坐标为沉淀物质的量,横坐标为溶液中加入物质的量)实验与图象对立关系正确的是
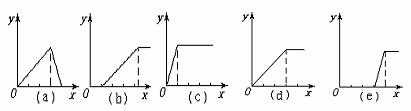
A.(1)和(a) B.(2)和(b) C.(3)和(e) D.(4)和(c)
13、由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2 在酸性条件下可以产生Cl2。下列关于混盐CaOCl2 的有关判断正确的是
A.该混盐具有和漂白粉相似的化学性质
B.该混盐的水溶液呈中性
C.该混盐与硫酸反应产生1 mol Cl2 时转移1 mol e-
D.该混盐中氯元素的化合价为零价
12、能正确表示下列反应的离子方程式是
A.醋酸钠的水解反应 CH3COO-+H3O+= CH3COOH+H2O
B.苯酚钠溶液与二氧化碳反应 C6H5O-+CO2+H2O = C6H5OH+CO32 -
C.碳酸氢钙与过量的NaOH溶液反应 Ca2++HCO3-+OH-= CaCO3↓+H2O
D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-= 3Fe2++2NO↑+4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com