
题目列表(包括答案和解析)
3.从石英砂制取并获得高纯硅的主要化学反应如下:
① SiO2+2C Si(粗)+2CO
Si(粗)+2CO
② Si(粗)+2Cl2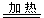 SiCl4
SiCl4
③ SiCl4+2H2 Si(纯)+4HCl
Si(纯)+4HCl
关于上述反应的分析不正确的是
A.①、③是置换反应,②是化合反应
B.高温下,焦炭与氢气的还原性均强于硅
C.任一反应中,每消耗或生成28 g硅,均转移4 mol电子
D.高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅
2.澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”, 它外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A.同系物 B.同分异构体 C.同位素 D.同素异形体
1. 下列有关化学用语正确的是
下列有关化学用语正确的是
A.Cl-离子的结构示意图:
B.北京奥运会奖牌--“金镶玉”奖牌玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为:2CaO·5MgO·8SiO2·H2O
 C.次氯酸的结构式为:H-Cl-O
C.次氯酸的结构式为:H-Cl-O
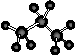
D.丙烷分子的比例模型示意图:
28.(10分)
某学习小组对教材实验“在200mL烧杯中放人20 g蔗糖(C12H22O11),加入适量
水,搅拌均匀,然后再加入15 mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究。
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色
物质,同时闻到刺激性气味。压缩“黑色面包”时,感觉较硬,放在水中呈漂浮状态。
同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③蔗糖炭化得到的碳连成整
体,碳原子间形成了化学键 ④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是 (填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
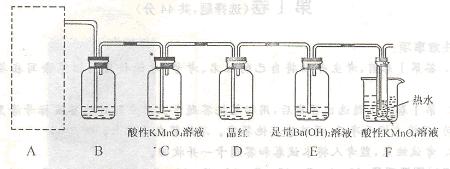
试回答下列问题:
①上图A中应选用下列装置 (填编号)。
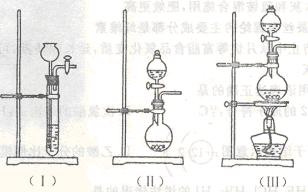
②B装置所装试剂是 ;D装置中试剂的作用是
;E装置中发生的现象是 ;
③A装置中使蔗糖变黑的化学反应方程式为 ;
④F装置中酸性高锰酸钾溶液颜色变浅的原因是
;
其反应的离子方程式是 。

27.(12分)
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,
有的是香料。它们的结构简式如下所示:
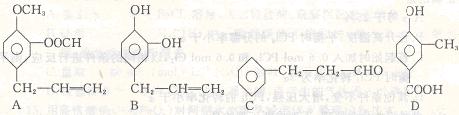
请回答下列问题:
(1)写出D中含氧官能团的名称: ;
1mol B能与 mol Br2反应;
(2)用A、B、C、D填空:
①能发生银镜反应的有 ;
②既能使FeCl3溶液显紫色,又能和NaHCO3反应放出气体的有
;
(3)如图:

C经一步反应可生成E,E是B的同分异构体,则反应①属于 反应
(填反应类型名称);
反应②的化学方程式为 ;
(4)同时符合①化合物是1,2一二取代苯,②苯环上的两个取代基分别为羟基和
含有一COO一结构基团要求的D的同分异构体有4种。
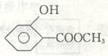
其中两种是
和 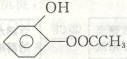 ,则另外两种的结构简
,则另外两种的结构简
式为
、 ;
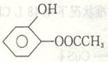
写出 与足量NaOH溶液反应的化学方程式:
。
26.(8分)
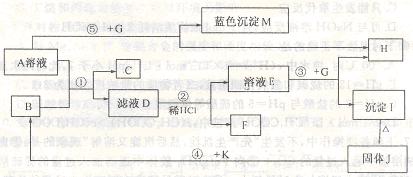
已知A是一种常见的盐,B、C、K为常见金属,K的氧化物是耐火材料,且能溶于
碱溶液。G为淡黄色固体,H、F为无色气体,F在空气中会变成红棕色。它们的转化
关系如下图所示(个别产物略去)。
请回答下列问题:
(1)A的化学式为 ;
(2)在反应①②③④中属于置换反应的是 (填序号);
(3)反应②的离子方程式为 ;
(4)反应⑤的总反应化学方程式为 。
25.(8分)
现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E
分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A
分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下均为液态;A
分别与E、F形成电子总数相等的气体分子。
请回答下列问题:
(1)元素F在周期表中的位置 ;
(2)A、C、D三种元素可组成一种常见化合物,该化合物的化学式为
;生产该化合物和单质F的工业称为 工业;
(2) B与F形成的化合物分子中,各原子均达8电子结构,则该分子的电子式为
;
(4)已知0.5 mol EC2被C2氧化成气态EC3,放出49.15 kJ热量,其热化学方程
式为 ;
(5)A、B、C以原子个数比4:2:3所形成的化合物,晶体类型为 。
24.(10分)
(1)在氯化铁溶液中,加入难溶的碳酸钙粉末,发现碳酸钙粉末逐渐溶解,同时还
产生的现象有:
① ;
② 。
(2)向含有氯化钡的氯化铁溶液中通人二氧化硫,有白色沉淀,此外还可产生的
现象是 ;其离子反应方程式为
。
(3)欲从酸化的氯化铁溶液中制得氯化铁晶体(FeCl3·6H2O)
实验基本操作是:将溶液蒸发、浓缩、 、 、过滤、干燥。
蒸发浓缩中使用的陶瓷仪器名称是 。
玻璃棒在过滤中的作用: 。
23.(8分)
已知某温度下,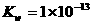 。A为酸溶液,其pH=a;B为碱溶液,其pH=b。
。A为酸溶液,其pH=a;B为碱溶液,其pH=b。
(1) 若A为强酸,B为强碱,且a+b=13,两者等体积混合后,溶液的pH=
;若此时溶液中阳离子浓度大于阴离子浓度,其原因可能是
(用文字表述);
(2)若A的化学式为HR,B的化学式为MOH,且a+b=13。若两者等体积混合
后溶液显碱性,则其原因可能是 ;
此混合后的溶液中,微粒浓度大小关系一定正确的是 (填序号)。
①c(MOH)>c(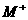 )>c(
)>c(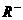 )>c(
)>c(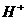 )2>c(
)2>c(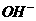 )
)
②c(HR)>c(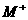 )>c(
)>c(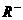 )2>c(
)2>c(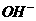 )>c(
)>c(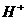 )
)
③c(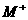 )>c(
)>c(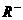 )>c(
)>c(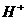 )>c(
)>c(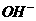 )
)
④c(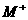 )>f(
)>f(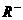 )>c(
)>c(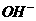 )>f(
)>f(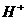 )
)
⑤c(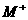 )十c(
)十c(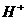 )一c(
)一c(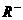 )+c(
)+c(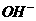 )
)
⑥c(MOH)=c(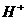 )-c(
)-c(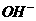 )
)
22.将一定量的钠铝合金置于水中,合金全部溶解,得到20
mL pH=14的溶液,然后用l mol·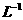 。的盐酸滴定,至沉淀质量最大时,消耗盐酸40 mL,原合金中钠的质量为
。的盐酸滴定,至沉淀质量最大时,消耗盐酸40 mL,原合金中钠的质量为
A.0.46 g B.0.69 g C.0.92 g D.0.23 g.
第Ⅱ卷答题栏(不使用机读卡者使用)
第Ⅱ卷(非选择题,共56分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com