
题目列表(包括答案和解析)
3.NA表示阿伏加德罗常数,下列说法中正确的是
A.3.6 g重氧水(H218O)中所含质子数为2NA
B.4.48 L N2所含分子数为0.2 NA
C.12g金刚石中含有C-C键的个数为2NA
D.1 mol氧气与足量钠点燃反应,转移4NA个电子
2.下列叙述合理的是
A.金属材料都是导体,非金属材料都是绝缘体
B.棉、麻、丝、毛及合成纤维完全燃烧都是只生成CO2和H2O
C.水电站把机械能转化成电能,而核电站把化学能转化成电能
D.我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染”
1.2008年北京奥运会的圣火很快就要传到石家庄,“祥云”火炬所用的燃料的主要成分是丙烷,下列有关丙烷的叙述中不正确的是
A.分子中碳原子不在一条直线上
B.光照下能够发生取代反应
C.比丁烷更易液化
D.是石油分馏的一种产品
21.(10分)某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:
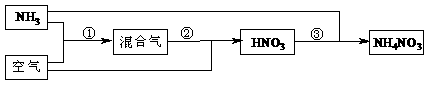
其中反应①为4NH3+5O2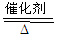 4NO+6H2O
4NO+6H2O
⑴步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为_____________________________________。
⑵若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
⑶假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?(要求写出解题过程)
出卷:洪 强
校核:高三化学备课组
20、(8分)有甲乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) 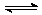 xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:(1)甲平衡时A的体积分数为 ;
xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:(1)甲平衡时A的体积分数为 ;
(2)若乙W%=40%,且建立平衡的过程中乙压强有变化 ,则x= ,乙中建立平衡时压强的变化为 (填“递增”或“递减”)。
(3)若乙W%=40%,且平衡时甲、乙压强不同,则x= ,平衡时甲的压强 乙的压强(填“大于”或“小于”),乙平衡时c(A)平= 。
(4)若x=4,则W% 40% (填“大于”、“小于”或“等于”,下同);平衡时乙中的c(A)
甲中的c(A)。
19.(8分)汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g)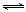 2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
⑴右图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,根据图像判断反应N2(g)+O2(g)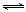 2NO(g)为 (填“吸热”或“放热”)反应。
2NO(g)为 (填“吸热”或“放热”)反应。
⑵2000℃时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则2000℃时该反应的平衡常数K= 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为 。
⑶为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。
写出上述变化中的总化学反应方程式: 。
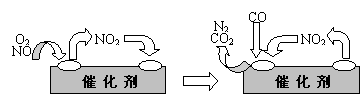
18.(12分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
|
物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
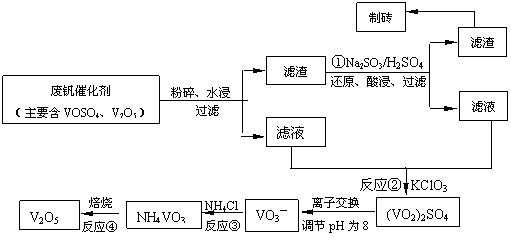
|
请回答下列问题:
(1)23V在元素周期表位于第 周期 族。工业上由V2O5 冶炼金属钒常用铝热剂法,其用化学方程式表示为 。
(2)反应①的目的是 。
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量: VO2+ + H2C2O4 + H+ → VO2+ + CO2 + ______。
短线上填写物质的化学式或离子符号后,写出配平后完整的离子方程式。
 。
。
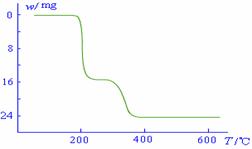
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示。则NH4VO3在分解过程中 。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
17.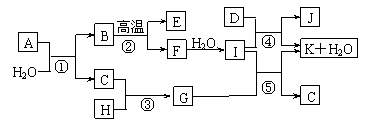 (8分)下图所示各物质是由1-20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
(8分)下图所示各物质是由1-20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
⑴物质E的电子式是____________。
⑵反应⑤的化学方程式为___________________________________________。
⑶反应③的现象为___________________________________________。
⑷物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A化学式为________。
16.(14分)近期有两件事引起了人们的极大关注。
(1)“问题奶粉”①其问题主要是掺杂了三聚氰胺,该物质的结构如图,该物质的含氮量为 ,蛋白质是由不同氨基酸组成的,根据组成的不同,其含氮量一般在15~17.6%之间变化。而农业用氮肥中包括碳酸氢铵、硝酸铵以及尿素,含氮量依次增加,以尿素最高,理论值为 现代工业合成三聚氰胺主要使用尿素为原料,在加热和一定压力条件下生成该物质及氨和二氧化碳,试写出化学方程式
②该物质遇强酸或强碱水溶液水解,氨基逐步被羟基取代,先生成三聚氰酸二酰胺,进一步水解生成三聚氰酸一酰胺,最后生成三聚氰酸。经研究表明三聚氰胺和三聚氰酸在肾细胞中结合沉积从而形成肾结石,堵塞肾小管,最终造成肾衰竭。试写出三聚氰胺生成三聚氰酸的化学方程式 。
(2) “神七问天” ①联氨(N2H4)是航天飞船常用的高能燃料。联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
②联氨也可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,写出其反应的化学方程式 。
③火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量;
H2O(l)=H2O (g) DH=+44 kJ·mol-1 2H2O2(l)=2H2O(l)+ O2(g) DH=–196.4 kJ·mol-1
则写出表示联氨燃烧热的热化学方程式为 。
15.(12分)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
|
指标 项目 |
优等品 |
一等品 |
合格品 |
|
外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20. 5% |
 某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观] 该硫酸铵化肥无可见机械性杂质。
[实验探究]
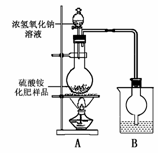
按右图所示装置进行实验。
(1)烧瓶内发生反应的离子方程式为:
烧杯中盛放的试剂最好是 (填“浓硫酸”、“稀硫酸”或“水”)
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
[交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:
乙同学:实验装置中还存在另一个明显缺陷是:
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论]
称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥 (填“是”或“不是”)一等品
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com