
题目列表(包括答案和解析)
14.(6分)已知: NO3-+4H++3e→NO+2H2O 。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中有一种(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:___________________________________。
(2)反应中硝酸体现了________________ 、________________ 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________________ mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:_________
________________________________。
13.在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量。则下列叙述正确的是
A.在实验过程中水的电离程度的变化趋势是先减小后增大
B.当滴加盐酸至溶液pH=7时,此时溶液中,c(NH4+)=c(Cl-)
C.当滴加盐酸至溶液pH<7时,此时溶液中溶质一定是HCl和NH4Cl
D.若滴加盐酸后,溶液pH >7,则此时溶液中溶质一定是NH4Cl和NH3·H2O
第Ⅱ卷
12.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A
= H+ + HA-,HA- H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是:
H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是:
A.因为A2-+H2O  HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性
B.0.1mol·L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol·L-1
C.NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH- )
D.在NaHA溶液中,HA-电离的趋势大于其水解的趋势
11.下列反应的离子方程式正确的是
①亚硫酸钠溶液中加入硝酸:SO32-+ 2H+ = H2O + SO2↑
②澄清石灰水跟稀硝酸反应:Ca(OH)2 + 2H+ = Ca2+ + 2H2O
③向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++ SO42- + NH4+=BaSO4↓+ NH3↑+2H2O
④0.1molFeBr2中滴入含Cl20.1mol氯水:2Fe2++4Br-+3Cl2=2Fe3++2Br2 +6Cl-
|
⑥硫化钠的水解:S2-+ 2H2O 
 H2S + 2OH-
H2S + 2OH-
⑦向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++ HCO3- +OH-=CaCO3↓+H2O
⑧苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO 32-
A.③⑤ B.①③ C.③⑤⑥ D.①②④⑥
10.25℃时,在25 mL o.1 mol·L-1的NaOH溶液中,逐滴加入 0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,正确的是
 A、B点的横坐标a=12.5
A、B点的横坐标a=12.5
B、C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C、D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
D、曲线上A、B间任一点,溶液中都有:
c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
9.对于平衡:2A+2B C+2D+3E+H2O(A、B、C、D、E为溶液中可自由移动的微粒),下列判断正确的是:
C+2D+3E+H2O(A、B、C、D、E为溶液中可自由移动的微粒),下列判断正确的是:
A.加水平衡左移
B.增加A,可提高B的转化率
C.平衡后,按起始投料比,再次投入A和B,则A和B的转化率都将增大
D.升温该平衡一定发生移动。
8.已知25℃时,AgI饱和溶液中c (Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c (Ag+)为1.25×10-5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-)
B.c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-)
C.c (NO3-)>c (K+)>c (Ag+) >c (Cl-)>c (I-)
D.c (K+)>c (NO3-) >c (Ag+) = c (Cl-) + c (I-)
7.工业生产中物质的循环利用有多种模式。例如:
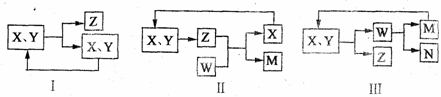
下列表述正确的是
A、图I可用于合成氨中的N2、H2的循环
B、图I可用于氨碱法制纯碱中CO2的循环
C、图Ⅱ可用于电解饱和食盐水中NaCl的循环
D、图Ⅲ可用于氨氧化法制硝酸中NO的循环
6.固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。下列关于A的说法正确的是:
A.固体A属于分子晶体 B.A加热分解产生的两种气体是氨气和氢气
C.A与水发生的反应是氧化还原反应 D.A属于铵盐,溶于水后,水解呈酸性
5.三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3 。则下列说法错误的是:
A.反应过程中,被氧化与被还原的元素的物质的量之比为1:2
B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉
C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染
D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com