
题目列表(包括答案和解析)
24-A.(8分)物质结构与性质
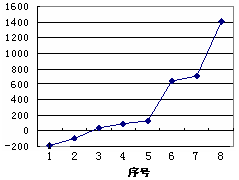 (1)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(填元素符号);其中电负性最大的是
(填右图中的序号)。
(1)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(填元素符号);其中电负性最大的是
(填右图中的序号)。
(2)请写出比元素1的原子序数大8的元素的基态原子电子排布式 。
(3)元素7的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
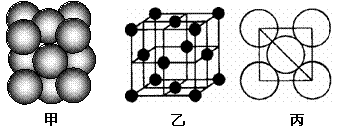

若已知7的原子半径为d,NA代表阿伏加德罗常数,7的相对原子质量为M,请回答:
①晶胞中7原子的配位数为___ ___ _ ,一个晶胞中7原子的数目为_ _;
②该晶体的密度为______ _ (用字母表示)。
24-B.(8分)实验化学
工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl = CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:
|
物质 |
开始沉淀时的pH |
|
||
|
Fe(OH)3 |
1.9 |
3.2 |
||
|
Fe(OH)2 |
7.0 |
9.0 |
||
|
Cu(OH)2 |
4.7 |
6.7 |
(1)若提供的药品有:Cl2、浓H2SO4、NaOH溶液、CuO、Cu,试结合题给表格请参照,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
________________________________________________________________。
(2)将除去Fe2+后所得溶液小心加热浓缩,再冷却结晶,即可得CuCl2·xH2O。
①过滤操作中需要的玻璃仪器有________________________________________。
②经检测,CuCl2·xH2O中含水28.6%,则CuCl2·xH2O中x的值为 。
③如果要将CuCl2·xH2O处理为无水氯化铜,如何操作:
23.(8分)在一定温度下,向一个容积不变的密闭容器中加人 2 molA 和 2 molB ,发生反应:2A (
g ) + B ( g )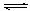 3C ( g ) ;ΔH=-akJ/mol 。在该条件下达到平衡时放出的热量为 bkJ , B 的体积分数为ω1%。若向此平衡容器中再充人 1 molB 和 3 mo1C ,在相同温度下达到平衡时 B 的体积分数为ω2 % ,反应过程中吸收的热量为c kJ 。则:
3C ( g ) ;ΔH=-akJ/mol 。在该条件下达到平衡时放出的热量为 bkJ , B 的体积分数为ω1%。若向此平衡容器中再充人 1 molB 和 3 mo1C ,在相同温度下达到平衡时 B 的体积分数为ω2 % ,反应过程中吸收的热量为c kJ 。则:
(1)ω1% ω2 % (填“ > ”、“=”或“ < " )。
(2)b c (填“ > ”、“=”或“ < ”或“不确定”)。
(3)a 、 b 、c三者的数学关系为 (用不等式或等式表示)。
(4)若A、B、C的起始加入量分别为xmol、ymol、zmol,达平衡时B的体积分数仍为ω1%,则x、y、z应满足的关系是 ,设第一次达到平衡时A的物质的量为n,则现状况下达到平衡时A的物质的量为 mol(用n、x、z表示)。
22.(7分)向某密闭容器中加人 0 . 3 molA 、 0 . 1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为 t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同。已知, t3 ~t4阶段为使用催化剂[已知 t0~ t1阶段 c ( B)未画出] 。
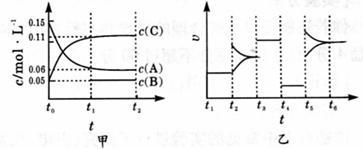
( 1 )若 t1= 15 s ,则t0~ t1阶段以 C 浓度变化表示的反应速率为v( C )=____。
( 2 ) t4 ~t5阶段改变的条件为________ , B 的起始物质的量为______。
( 3 ) t5 ~t6阶段容器内 A 的物质的量共减少 0 . 03 mol ,而此过程中容器与外界的热交换总量为 akJ ,写出该反应的热化学方程式___________________
21.(8分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
⑵将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则 (填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
20.(7分)下左表是元素周期表的一部分。表中所列的字母分别代表某一元素。
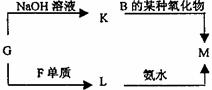

(1)1molA与D的氢化物完全反应产生的气体在标准状况下的体积为 。(2)写出B的最高价氧化物的电子式 。
(3)表中的另一种金属元素(未标出)的单质G,可以发生如上右图所示转化,其中化合物M是一种白色胶状沉淀,则M为(填经学式) ;K的溶液与B的某种氧化物反应的化学方程式为 。
(4)表中的另一种非金属元素(未标出)H与C元素组成一种新型无机非金属材料,该新型无机非金属材料抗腐蚀能力强,除氢氟酸外,它不与其它无机酸反应,试推测该无机非金属材料被氢氟酸腐蚀的化学方程式 。
19.(8分)有下图所示的装置:
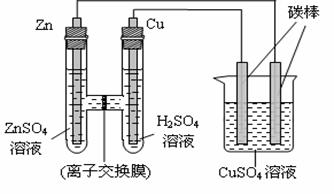
该装置中离子交换膜只允许 离子通过。反应一段时间后,向烧杯中加入0.1mol Cu(OH)2后恰好恢复到反应前的CuSO4溶液的浓度和pH。则反应过程中消耗锌的质量为 g ,烧杯左侧碳棒上析出物质的量为 mol。在此过程中,铜棒及烧杯右侧碳棒上发生的电极反应依次为:
铜棒: ;碳棒:
18.(6分)铁合金是金属材料王国的霸主,亚铁盐、铁盐、高铁酸盐等铁的重要化合物也在不同领域中个扮演着重要的角色。这些化合物之间可以相互转化,利用转化过程中发生的特征变化,不仅能够实现物质或能量的转化,还用于化学的定性或定量研究。
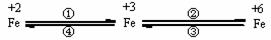
已知FeO42-只能在强碱性介质中稳定存在,在酸性介质或水中不稳定:
4FeO42-+20 H+ ==4Fe3+ + 3 O2↑+10 H2O;
4FeO42-+10 H2O== 4Fe(OH)3 + 3 O2↑+8 OH-
请利用下列用品:FeCl2溶液(浅绿色)、FeCl3溶液(黄色)、Na2FeO4溶液(紫红色)、铁粉、KSCN溶液、NaOH溶液、NaClO溶液、盐酸、金属锌片、惰性电极(或放电物质做电极)材料、蒸馏水及必要的实验仪器完成下列任务:
(1)设计一个实现上述转化④的实验方案(要求产物纯净),写出简要的实验步骤:
(2)在浓碱中,用NaClO可以实现转化②,这一反应的离子方程式为:
。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M = Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:

请写出MFe2Ox分解SO2的化学方程式________________________________(不必配平)。五、(本题包括3小题,共23分)
17.(10分)已知X和Y是由两种中学常见元素组成的化合物,A、B为气体,G为白色沉淀,F是一种两性化合物,在电解开始时溶液中有白色沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为C的澄清溶液,X、W、E的焰色反应均为黄色。X~G各物质之间的关系如图(部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。
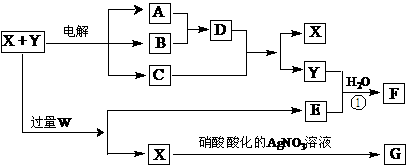
⑴X、Y、W的化学式分别为_____________________________________;
⑵写出反应①和电解开始时的离子方程式:
① ;② ;
⑶若要在电解后期得到C的澄清溶液,X和Y必须满足的条件是:____ _ 。
⑷向C的澄清液中加入1mol/L的硫酸,当加至50mL时才开始出现沉淀。假设电解过程中溶液体积变化忽略不计,原X和Y混合液的体积为100ml,原Y溶液的物质的量浓度为amol/L,则原X溶液的物质的量浓度为 mol/L。
16.(3分)某无色溶液可能含有下列离子中的几种:H+、Mg2+、Na+、Ag+、Cl-、OH-、HCO3-、NO3-,已知该溶液能和金属铝反应,放出的气体只有氢气。试推断:若溶液和铝反应后有AlO2-生成,则原溶液中一定大量含有的离子是___ __ _,还可能有较大量的离子是_____ _;若溶液和铝反应后有Al3+生成,则原溶液中一定不大量含有的离子是__ ____。
15.(2分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
(1)已知:2Fe + 3/2O2 = Fe2O3,△H = -Q1 kJ/mol; 2Al + 3/2O2 = Al 2O3,△H = -Q2 kJ/mol ,则Q1 Q2(填“>”,“<”或“=”);
(2)已知:CaCO3(s) == CaO(s) + CO2(g);ΔH=178.2kJ·mol-1,该反应自发进行的条件是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com