
题目列表(包括答案和解析)
9.(12分)实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%-30%的稀硫酸溶液,在50℃-80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式: 。
(2)硫溶液过稀会导致 。
(3)采用水浴加热的原因是 。
(4)反应时铁屑过量的目的是(用离子方程式表示) 。
(5)溶液趁热过滤的原因是 。
塞紧试管口的目的是 。
(6)静置冷却一段时间后,在试管中观察到的现象是 。
2.已知在热的碱性溶液中,NaClO发生如下反应:3NaClO 2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
A.NaCl、NaClO B.NaCl、NaClO3 C.NaClO、NaClO3 D.NaClO3、NaClO4
3.氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3++N2+3C 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1molAlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
4.在下列溶液中,各组离子一定能够大量共存的是( )
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C. c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
5.下列化学反应的离子方程式正确的是( )
A.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH +HCO
+HCO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3 +2HClO
+2HClO
C.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO =CaSO4
=CaSO4 +H2O
+H2O
6. 下列各组物质的无色溶液,不用其它试剂即可鉴别的是( )
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4
③HCl NaAlO2 NaHSO4 ④Ca(OH)2 Na2CO3 BaCl2
A.①② B.②③ C.①③④ D.①②④
7.已知:H2(g)+F2(g) 2HF(g)+270kJ,下列说法正确的是( )
2HF(g)+270kJ,下列说法正确的是( )
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
8.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3 B.Na2O2 Na2CO3
C.NaOH Na2CO3 D.Na2O2 NaOH Na2CO3
(非选择题60分)
1.锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
A.2mol B.1 mol C.0.5mol D.0.25mol
21. (10分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。已知生成C1O
(10分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。已知生成C1O 离子的反应为:
离子的反应为:
6Ca(OH)2+6C12
5CaC12+Ca(C1O3)2+6H2O。
⑴t2时,Ca(C1O)2与Ca(C1O3)2的物质的量之和为 mol。
⑵该石灰乳中含有Ca(OH)2的质量是_______g。
⑶据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和C1O3-的比例也不同。若 ,则500mL溶液中 c(C1-)为多少?(用含a的代数式来表示)
,则500mL溶液中 c(C1-)为多少?(用含a的代数式来表示)
20.(6分)元素R的最高价氧化物对应的水化物的化学式为HxROy,气态氢化物的化学式为HzR, 已知1 mol HzR 比1 mol HxROy质量少64g,则
⑴ y= ,x与z的关系为x z(填“>”、“<”或“=”);
⑵ 若R为短周期元素,又知1 mol HxROy中R原子的核外电子总数比氢原子和氧原子核外电子总数之和少16 mol,则R的原子序数为 。
19.(7分)为分析县城的空气质量情况,校化学研究性学习小组的同学拟测定县城上空空气中SO2的含量并制定了下列研究方案:
Ⅰ.相关文献调研:了解空气中主要污染指标,其中SO2对人体有哪些危害;了解SO2的化学性质,为测定SO2的含量寻找理论依据[资料表明,SO2具有较强的还原性,能与酸性KMnO4溶液(紫色,其还原产物Mn2+在水溶液中接近无色)发生如下反应:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+]。
Ⅱ.设计实验方案:
方案一:利用SO2能使品红溶液褪色的原理进行半定量分析;
方案二:利用SO2的还原性进行定量分析。
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽。
Ⅳ.选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后。
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议。
请你参与该研究性学习小组的活动并发表你的见解:
⑴ 如果利用方案一对空气中SO2的含量半定量分析,你建议配制的品红溶液的浓度 (选填“宜大不宜小”、“宜小不宜大”或“大小均可”);
⑵ 该小组的同学拟用下列装置通过方案二定量分析空气中SO2的含量:

①通入空气前应进行的实验操作是 ;
② 当看到 现象时,应停止通空气;
实验过程中需测量并记录的数据: 。
⑶ 下图是该小组同学根据实验测得的县城不同地区空气中SO2含量:
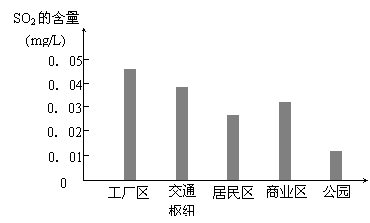
① 工厂区、交通枢纽SO2含量明显高于其他地区的原因是 ;
② 请你向当地有关部门提出一条减少工厂区SO2排放的建议 ;
⑷ 下表是该小组同学测得的不同天气情况下的县城空气中SO2的平均含量。请你分析雨后或风速较大时SO2平均含量较低的原因 。
|
天气情况 |
平均风速(m/s) |
空气中SO2的平均含量(mg/L) |
|
雨 前 |
2.0 |
0.03 |
|
雨 后 |
2.2 |
0.01 |
|
晴 |
23 |
0.015 |
|
晴 |
0.9 |
0.03 |
18.(12分)下图是元素周期表中的前四周期,回答下列问题:
|
① |
|
|
|||||||||||||||
|
|
② |
|
③ |
④ |
⑤ |
|
⑥ |
|
|||||||||
|
|
|
|
|
⑦ |
|
|
|
||||||||||
|
⑧ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑴按原子轨道的重迭方式,①与④形成的化合物中的共价键属于 键。
⑵②、⑤、⑥、⑧4种元素第一电离能由高到低的顺序是 (用元素符号表示)。
⑶元素④形成的单质的晶体类型可以是原子晶体如 (填写物质名称),也可以是 如C60。
⑷元素③、⑥形成的化合物与⑦的氢化物均为AB3型,但这2种化合物分子的立体结构明显不同。③、⑥2种元素形成的化合物分子的立体结构为 ,⑦的氢化物分子的立体结构为 。
17.(10分)胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;(2)能溶于水,水溶液呈弱碱性;(3)遇酸及酸性药物则产生二氧化碳;(4)胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:(1)与胃酸是中和作用缓慢而持久,可维持3-4小时。(2)凝胶本身覆盖于溃疡面上,具有保护作用。(3)可溶于稀酸或氢氧化钠溶液中。
⑴根据所学知识,请你推测,甲中含有的主要化学成份是 (填化学式);乙中含有的主要化学成份是 (填化学式)。
⑵试写出甲中含有的主要化学成份引起胃胀气反应的离子方程式:
。
⑶试写出乙中含有的主要化学成份和氢氧化钠溶液反应的离子方程式:
。
⑷在两支装有浑浊水(混有少量泥沙)的试管中,分别加入少量乙的主要成份和少量的硫酸铁,静置一段时间,两试管中水均变得澄清透明。请以硫酸铁为例用离子方程式说明产生此现象的原因: 。
16.(14分)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子反应方程式是 , 。
⑵该同学猜想血红色溶液变为无色溶液液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
⑶该药品须密封保存,若表面出现颜色变化,说明部分+2价铁已变成+3价铁。请你运用物质结构的知识解释Fe3+比Fe2+稳定的原因 。
15.(8分)化学课上,某班同学围绕硫酸及其盐的性质进行如下探究,请你填写有关答案。
⑴取一小粒金属钠,小心放入盛有硫酸铜稀溶液的烧杯中,用漏斗倒扣在烧杯上,观察到金属钠在液面上四处游动,有大量气泡生成,收集产生的气体并点燃,火焰呈淡蓝色,该气体是 (填化学式)。溶液中同时有蓝色沉淀 (填化学式)生成。
⑵“绿色化学”要求综合考虑经济、技术、环保等方面来设计化学反应路线。若以铜为原料制取硫酸铜,请你设计符合“绿色化学”思想的反应路线(用化学方程式表示)。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com