
题目列表(包括答案和解析)
7.下列排列顺序正确的是 ( )
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④结合质子能力:OH->CH3COO->Cl-
A.①③ B.②④ C.①④ D.②③
6.有关如右图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )
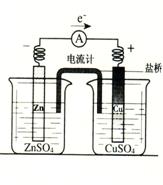 A.反应中,盐桥中的K+会移向CuSO4溶液
A.反应中,盐桥中的K+会移向CuSO4溶液
B.取出盐桥后,电流计依然发生偏转
C.铜片上有气泡逸出
D.反应前后铜片质量不改变
5.只靠一组镍氢电池驱动,一台试运行的混合动力公交车两年内跑了10万公里。大功率镍氢动力电池及其管理模块,是国家“十五”863计划电动汽车重大专项中一项重要课题。我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6
(LaNi5H6中各元素化合价均为零),电池反应通常表示为LaNi5H6 + 6NiO(OH)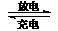 LaNi5 + 6Ni(OH)2 ,下列说法正确的是 ( )
LaNi5 + 6Ni(OH)2 ,下列说法正确的是 ( )
A.放电时电解质溶液中的OH-向正极移动
B.充电时阳极周围c(OH-)增大
C.充电时储氢合金作阳极
D.放电时负极反应:LaNi5H6+6OH――6e-=LaNi5+6H2O
4.下列现象或事实可用同一原理解释的是 ( )
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.氯水和二氧化硫均可使品红试液褪色
C.漂白粉和水玻璃长期暴露在空气中变质
D.乙炔和乙烯使溴的四氯化碳溶液褪色
3.用NA表示阿伏加德罗常数的值。下列叙述错误的是 ( )
A.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.一定温度下,1L0.5mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液含NH4+物质的
量不同
2.下列文字表述与反应方程式对应且正确的是 ( )
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓
B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
C.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+
 H2↑+ Cl2↑
H2↑+ Cl2↑
D.实验室用液溴和苯在催化剂作用下制溴苯: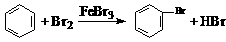
1.化学与生活、社会密切相关。下列说法不正确的是 ( )
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了防止白色污染
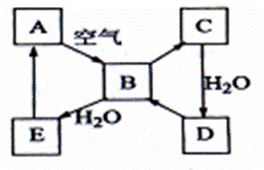
12. (16分)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式
____________________________________________________________
(2)写出E与A的氢化物反应生成A的化学方程式___________________________
(3)写出一个由D生成B的化学方程式____________________________________;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
①写出反应的离子方程式__________________________________________;
②反应后溶液的pH ______7(填“大于”、“小于”或“等于”),理由是________;
③加热反应后的溶液,其pH________(填“增大”、“不变”或“减小”),理由是________________________________。
11.(18分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
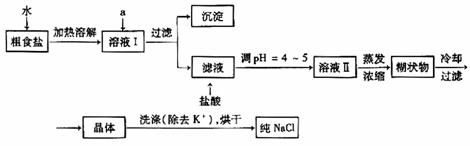
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液
Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_________(只填化学式)。
 ②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用
仪器除药匙、玻璃棒外还有________(填仪器名称)。
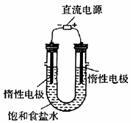
(3) 电解饱和食盐水的装置如图所示,若收集的H2为2 L,
则同样条件下收集的Cl2______(填“>”、“=”或“<”)2 L,原因是
__________。装置改进后,可用于制备NaOH溶液,若测定溶液中
NaOH的浓度,常用的方法是_____________。
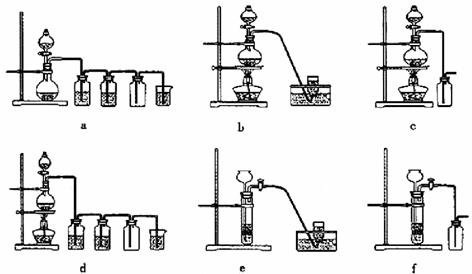
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收
集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:
10.(14分)(1)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+= __CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为___。KHC2O4的质量分数为___。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com