
题目列表(包括答案和解析)
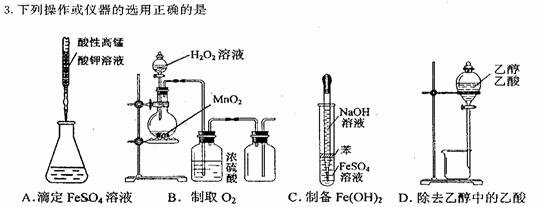
2.据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是
A.2H+ + 2e- = H2↑ B.2H2O + O2 + 4e- = 4OH-
C.Fe-2e- = Fe2+ D.4OH--4e- = 2H2O + O2↑
1.俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为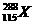 。下列有关叙述正确的是
。下列有关叙述正确的是
A.X元素的核外电子数为288
B.核素 的质量数与中子数之差为173
的质量数与中子数之差为173
C.113号元素属于非金属元素
D.115号元素的最高正化合价是 +5
29.(9分)小苏打、胃舒、平达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.5gNaHCO3,2片小苏打片和胃酸完全中和,被中和的H+是
___________mol。
(2)胃舒平每片含0.245gAl(OH)3。中和胃酸时,6片小苏打片相当于胃舒平_____片。
(3)达喜的化学成分是铝和镁的碱式盐。取该碱式盐3.01g,加入2.0mol·L-1盐酸使
其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应
完全,则该碱式盐样品中氢氧根与碳酸根的物质的量之比为 。
28.(10分)A-H及X均为中学化学常见物质, X是一种金属单质,A、B是非金属单质
且A在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)。
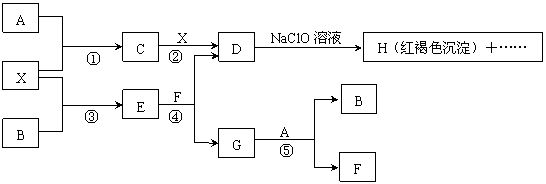
试回答下列问题:
(1)写出C物质的化学式 ;
(2)在上述①-⑤反应中肯定不属于氧化还原反应的是 (填编号);
(3)指出元素X在元素周期表中的位置:第 周期,第 族;
(4)请写出反应④和⑤的离子方程式: ④ , ⑤ ;
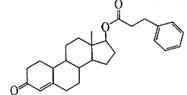
27.(8分)苯丙酸诺龙是一种兴奋剂,结构简式为:
(1)由苯丙酸诺龙的结构推测,它能 (填代号)。
 a.使溴的四氯化碳溶液褪色
a.使溴的四氯化碳溶液褪色
b.使酸性KMnO4溶液褪色
c.与银氨溶液发生银镜反应
d.与Na2CO3溶液作用生成CO2
苯丙酸诺龙的一种同分异构体A,在一定条件下
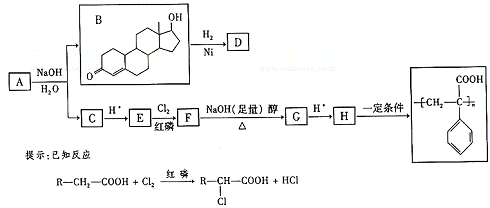 可发生下列反应:
可发生下列反应:
据以上信息回答(2)-(4)题:
(2)B→D的反应类型是 ;(3)C的结构简式为 ;
(4)F→G的化学方程式是 。
26.(12分)A、B、C、D、E为主族元素。A、B、C同周期且原子半径逐渐减小,A、
B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素最外层电子
数为次外层电子数的两倍,B的氢化物可与它的最高价氧化物的水化物反应生产盐。
D元素位于元素周期表中第一个长周期,是维持青少年骨骼正常生长发育的重要元素
之一,其原子最外层电子数等于最内层电子数。E是元素周期表中原子半径最小的元
素。试回答下列问题:
(1)C元素离子的结构示意图是 。
(2)A、B两元素各有多种氢化物,其电子数为10的氢化物中沸点较高的是 。
(填化学式),B的10电子氢化物的分子空间构型为 。
(3)B与E可形成离子化合物BE5、BE5的电子式是 ,含有的
化学键类型有 。
(4)下列晶体结构示意图中(●代表阳离子,○代表阴离子),能表示C与D形成的离
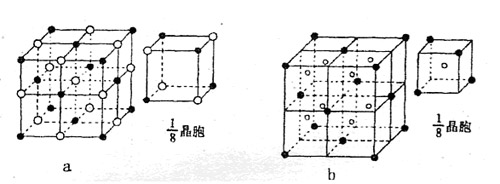 子化合物结构是
(填字母标号a或b)
子化合物结构是
(填字母标号a或b)
25.(14分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验
中可能会发生下
列反应:
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2
 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C
2MgO+C
④Mg+H2O MgO+H2↑ ⑤Mg3N2
+6H2O
MgO+H2↑ ⑤Mg3N2
+6H2O  3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应
是完全的,整套装置的末端与干燥管相连)。

回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分
别 ;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的
储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)_______________ _;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?__________,
原因是___________;
(4)请设计一个实验,验证产物是氮化镁: _____________ 。
24.向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中
离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完
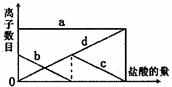 全正确的是
( )
全正确的是
( )
A.a:Cl-;b:K+;c:CO32-;d:HCO3-
B.a:K+;b:CO32-;c:Cl-;d:HCO3-
C.a:K+;b:CO32-;c:HCO3-;d:Cl-
D.a:K+;b:HCO3-;c:Cl-;d: CO32-
|
23. 如图为某有机物的结构简式。已知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:
如图为某有机物的结构简式。已知酯类在铜铬氧化物(CuO·CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢化过程中不变,其反应原理如下:
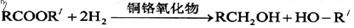 关于该化合物的下列说法中,不正确的是 ( )
关于该化合物的下列说法中,不正确的是 ( )
A.该有机物的化学式为C20H14O5
B.该有机物可以与浓溴水反应
C.与足量氢氧化钠溶液充分反应,所得产物中有醇类物质
D.1mol该有机物在铜铬氧化物催化下仅能与2mol氢气发生反应
21. 在等温等容条件下有下列反应:2A(g)+2B(g) C(g)+3D(g)。现分别从两条途
在等温等容条件下有下列反应:2A(g)+2B(g) C(g)+3D(g)。现分别从两条途
径建立平衡:(Ⅰ)A和B的起始浓度均为2mol/L;(Ⅱ)C和D的起始浓度分别为
2mol/L和6mol/L。下列叙述正确的是 ( )
A.Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的各物质的量相同
B.达到平衡时,Ⅰ途径混合气体密度为Ⅱ途径混合气体密度的2倍
C.Ⅰ和Ⅱ两途径最终达到平衡时,体系内各气体的体积分数相同
D.达到平衡时,Ⅰ途径的反应速率VA等于Ⅱ途径的反应速率VB
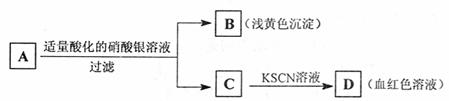 22.某学生设计了如下图中的方法对A盐进行鉴定 ( )
22.某学生设计了如下图中的方法对A盐进行鉴定 ( )
由此分析,下列结论中,正确的是
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com