
题目列表(包括答案和解析)
21.(13分)A、B、C、D为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,A有5个原子核。通常状况下,C为无色液体,已知:A+B C+D。
C+D。
(1)B的电子式是_______________________。
(2)液态D与液态C的电离相似,都可电离出电子数相同的两种离子,液态D的电离方程式是_________________________。
(3)用图示装置制备气体D的催化氧化产物并验证其还原性。有下列主要操作:
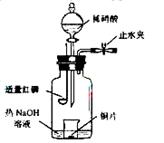 a、向广口瓶内注入足量热NaOH溶液,将盛
a、向广口瓶内注入足量热NaOH溶液,将盛
有Cu片的小烧杯放入瓶中。
b、关闭止水夹,点燃红磷,伸入瓶中,塞好
胶塞。
c、待红磷充分燃烧,一段时间后打开分液漏
斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要实验操作是_______________________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是_________________。
③步骤c滴入稀硝酸后烧杯中的现象是_________________________________。反应的离子方程式是________________________________________。
(4)一定温度下,将1molN2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色,温度继续由T1升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化如图所示。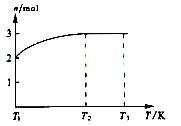
①温度在T1-T2之间,反应的化学方程式是___________________________。
②温度在T2-T3之间,气体的平均相对分子质量是(保留一位小数) _______________________。
20.(13分)试回答下列各问题:
(1)指出下面物质分子或离子的空间构型:
CS2_______________; PO43-___________________;
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式及电子式:
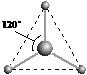 __________________,__________________;
__________________,__________________;
 __________________,__________________。
__________________,__________________。
(3)按要求写出第二周期非金属元素之间构成的中性分子的化学式:
平面三角形分子_________,三角锥形分子_________,正四面体形分子__________。
(4) 1919年美国化学家埃文·朗缪尔(Langmuir)提出:价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称为等电子体。由第一、二周期元素组成,与F2互为等电子体的分子有_____________、___________(写两种)离子有_______。(写一种)。
(5)下列一组微粒中为非极性分子的是____________________(用编号填写)。
①HCN ②SiF4 ③NH4+ ④SCl2 ⑤CH3Cl ⑥CH2=CH2
19. (6分)右图表示一个晶胞,该晶胞为正方体型,原子(或分子、离子)位于正方体的顶点和面心。试回答下列问题:
(6分)右图表示一个晶胞,该晶胞为正方体型,原子(或分子、离子)位于正方体的顶点和面心。试回答下列问题:
(1)若这是金属铜晶体的晶胞,则每个晶胞中含有Cu2+的数目为 ;
(2)若这是一个分子晶体的晶胞,其代表物质是 ;
(3)若这是一个不完整的金刚石晶胞,则晶胞中其他碳原子的数目和位置是 ;
(4)若这是一个不完整的NaCl晶胞,且顶点和面心的实心球表示Na+,则晶胞中Cl-位置是 ________ ;
(5)若这是一个不完整的CaF2晶胞,且已知CaF2中Ca2+周围等距离的存在着8个F-,则图中实心球表示 (填Ca2+或F-)。
18.(6分)2004年7月,法俄两国科学家共同宣布,在高压下,氮气会聚合生成高聚氮。在高聚氮晶体中,每个氮原子都通过三个单键与其它氮原子结合并向空间发展,构成立体网状结构。已知该晶体中N-N的键能为160kJ/mol,而氮气中N≡N的键能为942kJ/mol。则:
(1)高聚氮晶体属于 _____ 晶体。
(2)高聚氮转化为氮气时,将 ____ (“吸收”或“放出”)能量,当生成1mol N2时,能量变化是 ________ kJ。
17.(9分)2008年9月13日中央电视台报导了三鹿集团在牛奶中添加三聚氰胺使全国1200多名婴幼儿患上肾结石的“三鹿奶粉重大安全事故”,国务院立即启动国家重大食品安全事故I级响应。
就下列网上查得的有关三聚氰胺的物理物质资料回答问题:
 三聚氰胺性状为纯白色原子晶体。有难闻的气味,密度1.573克/厘米3 (16℃)。常压下为熔点354℃(分解),快速加热升华,升
三聚氰胺性状为纯白色原子晶体。有难闻的气味,密度1.573克/厘米3 (16℃)。常压下为熔点354℃(分解),快速加热升华,升
华温度为300℃。难溶于水,易溶于醚、苯和四氯化碳,
可溶于甲醇、乙酸、热乙二醇等。
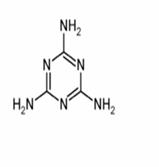
(1) 三聚氰胺为三个氰胺分子加聚而成如右图所示
的环状物,则三聚氰胺的分子式为_________,分子中
含氮的质量分数为________________;
(2)已知氰胺分子中除H原子外,C、N 原子的最外层均达8个电子的结构,则氰胺的电子式为_______________, 结构式为__________________。
(3)和相对分子质量相近的硝基苯比较 (无色或微黄色具苦杏仁味的油状液体。相对质量为分子量123.11。熔点5.7℃。沸点210.9℃)。三聚氰胺的熔点特殊的高,基原因是____________________________________________________________。
(4)上述有关三聚氰胺的物理性质叙述中有四处明显错误。请找出错误之处,同时在错误处下面画上横线,并根据你已有的知识把错误之处加以改正后填写在下列空格内①____________②______________③______________④______________;
16.(8分) 膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂,但膦在水中的溶解度远小于氨,微溶于水。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:
(1)P在元素周期表中的位置是 ,用电子式表示PH3的形成过程为 ;
(2)上述反应体系中化学反应方程式为_______________________________________,氧化产物是 ____ ;
(3)膦(PH3)在水中的溶解度远小于氨的原因是_________________________________。
15.某温度下,在一容积可变的密闭容器中反应
 2A(g) + B( g) 2C( g ) 达到平衡时,A、B、C的物质的量分别是4mol、2mol、4mol。保持温度和压强不变对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
2A(g) + B( g) 2C( g ) 达到平衡时,A、B、C的物质的量分别是4mol、2mol、4mol。保持温度和压强不变对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
A.均减半 B.均加倍 C.均增加1mol D.均减小1mol
第Ⅱ卷(非选择题,共55分)
14.下列离子方程式正确的是:

13.在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液: K+、NO3-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Al3+、NO3-、Cl-
C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.c(H+)水=10-12 mol·L-1K+、SO42-、Cl-、HCO3-
12.下列排列顺序正确的是
①热稳定性:H2O>HBr>H2S ②原子半径:O>Na>Mg
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
A.①③ B.②④ C.①④ D.②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com