
题目列表(包括答案和解析)
4.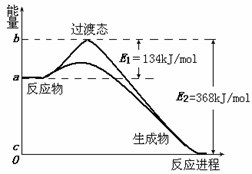 分析下图所示的四个原电池装置,结论正确的是
分析下图所示的四个原电池装置,结论正确的是
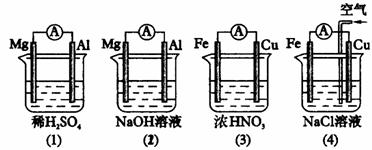
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为: 6 H2O +6e-=6OH-+3 H2↑
C.(3)中Fe作负极,电极反应式为: Fe一2e-=Fe2+
D.(4)中Cu作正极,电极反应式为: 2H++2e-=H2↑
3.在一定条件下发生反应:3A(g) + 2B(g) xC(g)
+ 2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6
mol C,又测得反应速率vB = 0.2 mol · L – 1 · min
– 1,则下列说法正确的是
xC(g)
+ 2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6
mol C,又测得反应速率vB = 0.2 mol · L – 1 · min
– 1,则下列说法正确的是
A.x = 3 B.B的转化率为20%
C.达到平衡时A的浓度为1.4 mol · L – 1
D.平衡时气体压强是原来的0.94倍
2.设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,8.8g CO2和N2O混合物中所含有的原子数为0.6 NA
B.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6 NA
C.标准状况下,3.36L丁烷中含有的非极性键数为0.6NA
D.在1L0.2mol/L的硫酸铁溶液中含有的三价铁离子数为0.6 NA
1.据最新报道,科学家发现了如下反应:O2 + PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是
A.在此反应中,O2氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1价
C.在此反应中,每生成1 mol O2(PtF6) 则转移1 mol电子
D.在O2(PtF6)中不存在共价键
21.(9分)下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,J为红棕色气体。D为黑色固体,M为红褐色胶体。
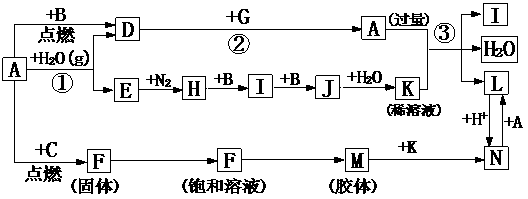
请回答下列问题:
(1)A元素在周期表中位于 周期 族。
(2)以F饱和溶液制备M胶体的操作为
。
(3)鉴别L溶液和N溶液的最简单的物理方法是
。
(4)反应③的离方程式为 。
20.(10分)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是_________。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子是___________,有关的离子反应式为______________________。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有_______________。
(4)原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________。
A.Cl- B.NO3- C.CO32- D.OH-
19.(10分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+、Mg2+、Al3+、Ba2+ |
|
阴离子 |
OH-、Cl-、CO32-、SO42-、HSO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是
A ;B ;C ;D ;E 。
18.(10分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
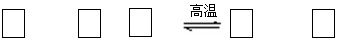
SiO2 + C+ N2 Si3N4 + CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应产生标准状况下11.2升CO气体,则电子转移 摩尔。
(4)若有1摩尔焦炭与足量的SiO2、氮气反应,电子转移 (填大于、等于或小于)2摩尔,理由是 。
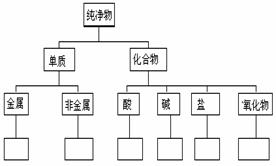
17.(6分)请按下列线条提示,画出Fe、Cu、S、H2、HCl、NaOH、H2SO4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl 的树状分类图:
16.(10分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:6FeO·Cr2O3 + 24NaOH
+7KClO3 12Na2CrO4
+ 3Fe2O3 +7KCl + 12H2O,
12Na2CrO4
+ 3Fe2O3 +7KCl + 12H2O,
试回答下列问题
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
。
(2)NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: 。
(3)操作③的目的是什么,用简要的文字说明: 。
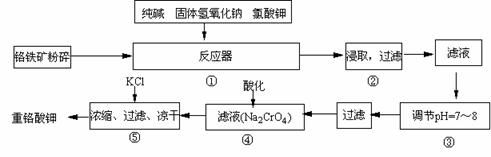
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:
。
(5)称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
判断达到滴定终点的依据是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com