
题目列表(包括答案和解析)
6.下列叙述正确的是( )
A.一定温度、压强下,气体体积由其分子的大小决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
5.在273K和101k Pa的条件下,将2.00g氦气、1.40g氮气和1.60g氧气混合,该混合气体的体积是( )
A.6.72L B.7.84L C.10.08L D.13.44L
4.由CO、H2和O2组成的混和气体60mL,在一定条件下恰好完全反应,测得生成物在101kPa120℃下对空气的相对密度为1.293,则原混和气体中H2所占的体积分数为( )
A.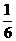 B.
B. C.
C.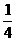 D.
D.
3.下列有关物理量相应的单位表达错误的是( )
A.摩尔质量g/mol B.气体摩尔体积L/mol
C.溶解度g/100g D.密度g/cm3
2.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.1.8g铵根离子所含的电子数为1.1NA
B.1mol白磷分子中所含共价键数为4NA
C.标准状况下22.4L乙醇所含的分子数必定为NA
D.7 g CnH2n中含有的氢原子数目为NA为1L.
1.下列各组中两种气体的分子数一定相等的是( )
A.温度相同、体积相同的O2和N2 B.质量相等、密度不等的N2和C2H4
C.体积相同、密度不相等的CO和C2H4 D.压强相同,体积相同的O2和H2
14.(1)b
(2)常压时SO2的转化率已经很大,增大压强会增加动力成本和设备成本;压强一定时,温度升高SO2转化率下降
(3)6.23×105 kJ
(4)V(SO2)∶V(SO3)∶V(O2)∶V(N2)= ( 0.46 )∶( 6.5)∶ (7.7 )∶82 (5)2a
14.硫酸工业生产应考虑综合经济效益。
(1)若从下列四个地区选址新建一座硫酸厂,最合适的地点应在_________附近。
a.风景旅游区 b.硫酸消耗中心区 c.人口稠密区 d.黄铁矿矿区
(2)工业生产硫酸的原料气成分(体积分数)为:SO2 7%,O2 11%,N2 82%。
 压强及温度对SO2转化率的影响如下:
压强及温度对SO2转化率的影响如下:
|
|
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是
____________________________________________________________________。
分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是____________________________________________________________________。
 (3)据测算,接触法制硫酸过程中,每生产1 t 98%的硫酸需消耗3.60×105 kJ能量。若反应:2SO2(g)+O2(g) 2SO3(g),ΔH=-196.6 kJ /mol放出的热量完全被利用,则每生产1 t 98%的硫酸可为外界提供_____________kJ能量(不考虑其他过程释放的能量)。
(3)据测算,接触法制硫酸过程中,每生产1 t 98%的硫酸需消耗3.60×105 kJ能量。若反应:2SO2(g)+O2(g) 2SO3(g),ΔH=-196.6 kJ /mol放出的热量完全被利用,则每生产1 t 98%的硫酸可为外界提供_____________kJ能量(不考虑其他过程释放的能量)。
(4)依据题给数据计算:在500℃0.1MPa条件下,二氧化硫的催化氧化达到平衡时,各种气体的体积比V(SO2)∶V(SO3)∶V(O2)∶V(N2)= ∶ ∶ ∶82 (结果保留两位有效数字)。
 (5)在一密闭容器中充入一定量的SO3,某温度下发生反应2SO3(g) 2SO2(g)+O2(g)
,反应达到平衡时,测得容器内压强增大了p%,若此时SO3的转化率为a%,则a的取值为
(用含p代数式表示)。
(5)在一密闭容器中充入一定量的SO3,某温度下发生反应2SO3(g) 2SO2(g)+O2(g)
,反应达到平衡时,测得容器内压强增大了p%,若此时SO3的转化率为a%,则a的取值为
(用含p代数式表示)。
13.(1)① 2Na2O2+2H2O = 4NaOH+O2↑ ② 用玻璃片在水面下盖住集气瓶口,将玻璃片与集气瓶一起移出水面,将盖有玻璃片的集气瓶正放在桌上。
(2)① 经计算,烧瓶中c(OH-)约为1 mol/L;因为c(OH-)在1.0×10-4 mol/L~2.5 mol/L时酚酞呈红色,因此红色迅速褪去不是由于溶液中c(OH-)过大造成的。
② 取烧瓶中的溶液于试管中,加入少量二氧化锰,有气泡放出,用带火星的木条检验,木条着火,说明溶液中可能有H2O2存在。
③ 取②中试管里的溶液滴加酚酞试液,溶液变红且不褪色,说明“红色迅速褪去”与H2O2的存在有关
13.11.利用下图所示装置制取氧气并进行相关的实验探究。
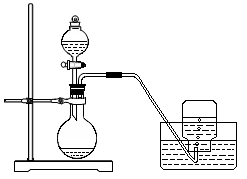
(1)将3.9 g过氧化钠放入烧瓶中,加入100 mLH2O,然后用排水法收集气体。 ① 过氧化钠跟水反应的化学方程式为________________________________。
② 集气瓶充满气体后,怎样从水槽中取出集气瓶?简述操作方法。 ______________________________________________________________
______________________________________________________________。
(2)已知:酚酞在c(OH-)在1.0×10-4 mol/L~2.5 mol/L时呈红色,且0.5 min内不会褪色;H2O2具有氧化性和漂白性。取上述实验得到的溶液于试管中,滴入2滴酚酞试液,溶液变红,片刻红色褪去。
① 有人认为,“红色迅速褪去”是由于溶液中c(OH-)过大造成的,试通过估算并
对比数据加以说明。
________________________________________________________________ _______________________________________________________________。
② 还有人认为,“红色迅速褪去”是因为溶液中存在H2O2。试设计实验证明烧瓶内的溶液中可能有H2O2存在,请简述实验操作。
__________________________________________________________________
_________________________________________________________________。
③ 补充实验,证明“红色迅速褪去”与溶液中存在H2O2有关。请简述实验操作。
__________________________________________________________________
_________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com