
题目列表(包括答案和解析)
22.重水(D2O)的离子积Kw=1.6×10-15,可以用pH一样的定义来规定pD=-lg[D+],试求该温度下:(lg 2 ≈0.3 )
①重水的pD=?
②含0.016molNaOD的D2O溶液1L其pD=?
③溶解0.01molDCl的D2O溶液1L其pD=?
④在100mL 0.25mol/L的DCl重水溶液中,加入50mL 0.2mol/L的NaOD的重水溶液,其pD=?
21.答案:10-13 ;(1)1:10; (2)10:1; (3)1:9。
21.某温度(t℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw= 。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
⑴若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
⑵若所得混合液为中性,且a+b=12,则Va︰Vb=
(3)若所得混合液的pH=10,且a=12,b=2,则Va︰Vb= 。
20.答案:⑴H2S、CH3COOH; H2A,可与同浓度的硫酸溶液导电性比较;⑵H2S H++HS-、HS-
H++HS-、HS- H++S2-;NaHCO3=Na++HCO3-,强;⑶=;<;醋酸为弱电解质,二者氢离子浓度相同时,醋酸的浓度大于盐酸的浓度,醋酸提供的氢离子的物质的量大于盐酸提供的氢离子的物质的量;⑷B;CH3COOH=CH3COO-+H+;Na2CO3+2H++2CH3COO-=2CH3COONa+H2O+CO2↑。
H++S2-;NaHCO3=Na++HCO3-,强;⑶=;<;醋酸为弱电解质,二者氢离子浓度相同时,醋酸的浓度大于盐酸的浓度,醋酸提供的氢离子的物质的量大于盐酸提供的氢离子的物质的量;⑷B;CH3COOH=CH3COO-+H+;Na2CO3+2H++2CH3COO-=2CH3COONa+H2O+CO2↑。
20.现有下列物质:H2S,NH3,H2SO4,NaHCO3,CH3COOH,KNO3溶液,盐酸,酒精,二元酸H2A等。请回答下列问题。
(1)其中一定属于弱电解质的是 。不能确定的是 ,请设计一个实验以证明它是强电解质还是弱电解质。你的实验和结论是
。
(2)H2S在水中的电离方程式为
NaHCO3在水中的电离方程式为
已知H2A的电离方程式为:H2A=H++HA-;HA- H++A2-。试判断H2A是 电解质(填“强”“弱”)。
H++A2-。试判断H2A是 电解质(填“强”“弱”)。
(3)2mol/L的盐酸和2mol/L的醋酸各100ml,分别与过量的Zn反应,相同条件下生成H2体积的V(盐酸) V(醋酸)(填>;=;<);氢离子浓度相等的盐酸和醋酸各100ml,分别与过量的Zn反应,相同条件下生成H2体积的V(盐酸) V(醋酸)(填>;=;<);理由是
(4)已知CH3COO-+H+ CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是( )
CH3COOH;现要使平衡向右移动且氢离子浓度增大,应采取的措施是( )
A.加NaOH B.加盐酸 C.加水 D.升高温度
已知CH3COOH在溶剂A中可以全部电离,盐不溶解于A溶剂。则CH3COOH在溶剂A中的电离方程式为 ;CH3COOH和Na2CO3在溶剂A中生成CO2反应的离子方程式是
19.答案:⑴溶液由黄色变为红色;⑵Cr2O72-+3H2S+8H+=2Cr3++3S↓+7H2O;⑶溶液由红色变为黄色,H+、Cr2O72-离子浓度降低。
19.已知在水溶液中,Cr2O72-离子呈红色,CrO42-离子呈黄色,Cr3+离子呈绿色,当K2Cr2O7溶液溶于水时,有下列平衡存在:Cr2O72-+H2O 2CrO42-+2H+。试回答:
2CrO42-+2H+。试回答:
⑴若往K2CrO4溶液里加硫酸溶液,观察到的现象是 。
⑵若往⑴所得溶液里通入H2S气体,观察到溶液呈绿色,并有浅黄色沉淀生成,其反应的离子方程式为 。
⑶另取一份K2Cr2O7,滴入NaOH溶液,其现象是 ,此时溶液中离子浓度下降的是 。
18.答案:A可能是H2SO4或CuSO4或MgSO4或(NH4)2SO4等。离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;Mg2++SO42-+Ba2++2OH-=BaSO4↓+Mg(OH)2↓。
18.在图(1)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入某种溶液(A)时,溶液的导电性的变化趋势如图(2)所示。
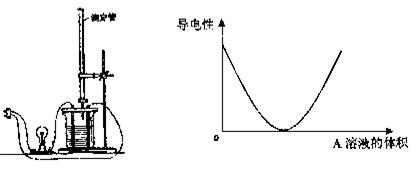
图1 图2
该根据离子反应的特点分析:A溶液中含有的溶质可能是_________或__________(至少写出两种),并写出相应的离子反应的离子方程式:
________________________ ___ _____
______________ ___________ ___
17.答案:(1)等倍数(如1000倍)地稀释两种溶液,稀释过程中pH变化大的是强酸,变化小的是弱酸。(2)在醋酸溶液中滴加石蕊试液,溶液变红色,证明醋酸能电离出H+;在上述溶液中加入少量的CH3COONH4晶体,振荡溶液,溶液颜色变浅,说明c(H+)变小,证明醋酸溶液中存在CH3COOH CH3COO-+H+的电离平衡。(注意:用CH3COONH4晶体而不是用CH3COONa晶体,是因为CH3COONH4在溶液中呈中性,故选择之。)
CH3COO-+H+的电离平衡。(注意:用CH3COONH4晶体而不是用CH3COONa晶体,是因为CH3COONH4在溶液中呈中性,故选择之。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com