
题目列表(包括答案和解析)
20、通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%
时,会引起明显的温室效应。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
⑴目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋
势,这一做法对环境的积极意义在于 。
⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中
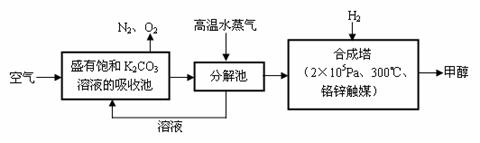 提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
①分解池中反应的化学方程式为 。
②在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出
合成塔中发生反应的热化学方程式 。
⑶李明同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)
分别为4.96×10-9、2.58×10-9。李明应该选用的试剂是 ,实验时测定的数据除空气的体积外,还需要测定 。
19、(10分)科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2 的物质,经测定,该物质易溶于水,在水中以SO42_和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是______________(填序号)
A. 同种单质 B. 同位素 C. 同分异构体 D. 同素异形体
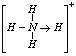 (2)N4H4(SO4)2___________(填“能”或“不能”)和草木灰混合施用。
(2)N4H4(SO4)2___________(填“能”或“不能”)和草木灰混合施用。
 (3)已知白磷、NH4+ 、N4H44+ 的空间构型均为四面体,NH4+的结构式为
(3)已知白磷、NH4+ 、N4H44+ 的空间构型均为四面体,NH4+的结构式为
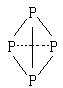
( 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
请画出N4H44+的结构式____________________________________;
(4)已知液氨中存在着平衡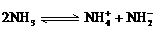 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________;
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________;
(5)含有一定量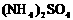 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
加酸时: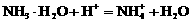 ;加碱时:
;加碱时: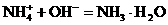
由于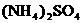 和
和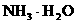 的大量存在,加少量酸或碱时,溶液中
的大量存在,加少量酸或碱时,溶液中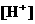 与
与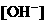 基本保持不变;
基本保持不变;
含有一定量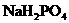 和
和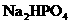 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时_______________________________;加碱时_________________________________
18、(10分)部分中学化学常见元素原子结构及性质如表所示:
|
序号 |
元素 |
结构及性质 |
|
① |
A |
A是生活中常见金属,它有两种氯化物,相对原子质量相差35.5 |
|
② |
B |
B原子最外层电子数是内层电子数和的1/5 |
|
③ |
C |
C单质分子中含化学键数最多,单质稳定,但其原子较活泼 |
|
④ |
D |
D被誉为“信息革命的催化剂”,常用的半导体材料 |
|
⑤ |
E |
通常情况下,E没有正化合价,A、B、C、D都能与E化合 |
|
⑥ |
F |
F在周期表中可以排在IA族,也有人提出排在ⅦA族、ⅣA族 |
(1)如果A与冷的浓硝酸作用发生钝化,工业上冶炼A单质的化学方程式为
____________________________________________
(2)A的氯化物的浓溶液分别滴入冷水、热水中,得到黄色和红褐色液体,区别两种液体
的方法是________________________________________________________
(3)B与C简单离子的半径大小为_________________(用离子符号表示)
(4) C和D形成的化合物的熔点很高,是一种无机非金属材料,其晶体类型为___________ ;
化学式为___________。
(5) F与E可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的
实验方法为:___________________________________________,F与C组成的两种化合物M、N,所含电子数分别与X、Y相等,请写出M的电子式___________,N的化学式___________.
(6)在上述六种元素中,选两种元素组成化合物甲,甲既含有离子键又含有共价键,甲的
化学式为___________
17、(8分)在热的稀硫酸溶液中溶解了11.4g硫酸亚铁固体,当加入50mL 0.5mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也完全反应并放出NxOy气体。
(1)推算出 x =_____;y =______。
(2)配平该反应的方程式:
__ FeSO4+ __ KNO3 +___H2SO4 - ____K2SO4 + ___Fe2(SO4)3 +____NxOy + ___H2O
(配平时x、y可用具体数值表示)
(3)反应中氧化产物是_______________。
(4)用双线桥法表示该反应中的电子转移方向和数目:_____________________________。
16、(6分)(Ⅰ)有一白色固体,可能是由Al2(SO4)3、AgNO3、BaCl2、NH4Cl、KOH、Na2S中的两种或三种组成。为确定该白色固体的组成,进行下列实验:取白色固体少许,加入蒸馏水充分振荡得无色溶液,再逐滴加入少许稀HNO3,有白色沉淀生成。
已知:Ag++2NH3·H2O=Ag(NH3)2++2H2O; Ag(NH3)2++2H+=Ag++2NH4+
AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O;试回答: (1)此白色固体中至少存在哪几种物质?请写出全部可能的情况 第一种情况 ,第二种情况: 第三种情况 ,第四种情况: (可不填满,也可被充) (2)若要证明固体的组成,还需做的实验是 。
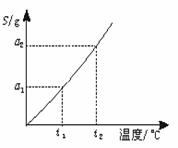 (Ⅱ)(4分) 摩尔质量为M g·mol-1的某物质溶解度曲线如右图所示,现有t2℃时300 g该物质的溶液,恒温蒸发掉50
g水后,溶液恰好达到饱和,此饱和溶液的密度为ρ g·cm-3,则其饱和溶液的物质的量浓度为
mol·L-1。若将饱和溶液降温到t1℃,析出晶体(不含结晶水)的质量为
。
(Ⅱ)(4分) 摩尔质量为M g·mol-1的某物质溶解度曲线如右图所示,现有t2℃时300 g该物质的溶液,恒温蒸发掉50
g水后,溶液恰好达到饱和,此饱和溶液的密度为ρ g·cm-3,则其饱和溶液的物质的量浓度为
mol·L-1。若将饱和溶液降温到t1℃,析出晶体(不含结晶水)的质量为
。
15、(Ⅰ)(4分)下列实验操作或对实验事实的描述正确的是 (填序号);
① 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入
少量铁粉。
② 配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏高;实验室测定中和
热时,过早读数会使测定结果偏低。
③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④ 实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤ 试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片
刻后管壁上有“银镜”出现
⑥ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦ 苯与溴水在铁粉的催化作用下制备溴苯
⑧ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消
耗的氢氧化钠溶液的体积一样多
(Ⅱ)(11分)在中学化学实验中,通常用无水硫酸铜来检验少量水的存在。由于无水硫酸铜吸湿性很强,需要现制现用。
方法甲:取2药匙细小的硫酸铜晶体置于_______中研碎后放入坩埚,将坩埚放在______上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入___________中进行冷却(请选用合适仪器填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角)。
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20 mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5 min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干。
[交流与讨论]
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是_________(用化学方程式表示)。
(2)方法乙中,浓硫酸的作用是__________;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是______ ,所用的主要玻璃仪器有烧瓶、接液管、锥形瓶、酒精灯________________等。
 (3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想______________________。
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想______________________。
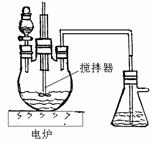
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
[问题一]如图装置中,分液漏斗内装的液体是________,反应结束时,获取CuSO4•5H2O的操作过程是先________________,趁热将三颈瓶中的液体倒入烧杯中冷却,析出晶体CuSO4·5H2O ,过滤、晾干。
[问题二]工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品-- 亚硝酸钙。尾气吸收生成亚硝酸钙的化学方程式是_______________。
14、工业上以CuO和H2SO4为原料制备CuSO4·5H2O晶体。为确保制备过程中既不补充
水,也无多余的水分,所用硫酸溶液溶质的质量分数应为。
A.45.8% B.57.6% C.72.3% D.无法确定
13、下列离子方程式正确的是
A.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-→BaCO3↓+H2O
B.亚硫酸氢铵和氢氧化钠的反应:NH4++OH-=NH3↑+H2O
C.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
D.碳酸氢镁溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
12、水热法制备Fe3O4纳米颗粒反应是3Fe2++2S2O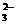 +O2+xOH-
+O2+xOH- Fe3O4+S4O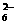 +2H2O,
+2H2O,
下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为4mol
B.Fe2+和S2O32-都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol D.x=2
11、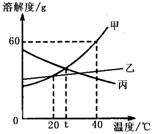 甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,以下说法不正确的是
甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,以下说法不正确的是
A.40℃时,100g水中最多溶解甲60g
B.t℃时,甲与丙的溶解度相等
C.分别将40℃时甲、丙的饱和溶液降温至t℃,
所得两溶液中溶质的质量分数相等
D.甲中混有少量乙,可用降温结晶法分离提纯甲
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com