
题目列表(包括答案和解析)
2.接触法生产H2SO4的过程中,对废气、废液、废渣和“废热”的处理正确的是
①尾气用氨水处理 ②污水用石灰乳处理
③废渣用来造水泥、炼铁 ④设置“废热”锅炉产生蒸气,供热或发电。
A.只有①② B.只有①③④ C.只有①②③ D.全部
1.关于电解NaCl溶液,下列叙述正确的是 ( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
52.测量一定质量的铝锌合金与强酸溶液反应产生氢气的体积,可以求得合金中铝和锌的质量分数.现有下列实验用品:中学实验常用仪器、800mL烧杯、100mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g/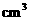 )、水.
)、水.
(1)请设计一个能测量一定量合金与金属反应放出气体的装置来(画图).
(2)补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略).
① 。
② 。③ 。
④ 。
(3)合金样品用铜网包裹的目的是: 。
9月26日完成!!!
51.三农问题是政府和社会关注的问题,化肥是土地的营养品。某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④……………………;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数。
请回答下列问题:
(1)写出步骤④中的实验内容 ,写出实验步骤④中的离子方程式: 。
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是( )
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是 。
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为 (填字母选项)。
A.50mL,50mL B. 150mL,100mL C. 100mL,150mL D. 250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为 。(不需要化简)
50.工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,此反应是放热反应。
 NH3 + CO2 + H2O + NaCl(饱和) NaHCO3(晶体)↓+ NH4Cl
NH3 + CO2 + H2O + NaCl(饱和) NaHCO3(晶体)↓+ NH4Cl
(1)某校学生实验小组利用上述反应原理,设计如图所示装置,制取碳酸氢钠晶体。C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
|
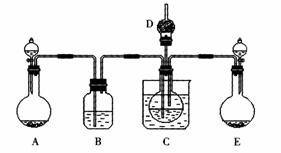 f.饱和氯化钠溶液。
f.饱和氯化钠溶液。
①A中制备气体时,所需药品是(选填字母代号) ;
②B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为 ;
④检验D出口处是否有氨气逸出的方法是 。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为wg。再将晶体加热到质量不再变化时,称量所得粉末质量为ng。然后进行如所示实验:

①在操作II中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号) ;
A.在加入氢氧化钡溶液后,振荡、静置,向溶液中继续加入少量氢氧化钡溶液
B.在加入氢氧化钡溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氢氧化钡溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作III的方法为 、 、 ;
③所得晶体中碳酸氢钠的纯度为 。
49.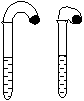 ⑴高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
⑴高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
①试管中(填产生沉淀或气体及反应速率等相关现象)
______________________________________________________
②盛______________的试管中气球变得更大,大小气球
(包含试管) 体积之比约为(填最简单整数比)____________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+ H+(aq) =H2O(l)+ CO2(g) ;△H>0
CO32-(aq)+ 2H+(aq)= H2O(l) + CO2(g); △H<0
甲下结论的方法是否正确____________ (填正确或不正确)
⑵ 为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
35mL水 |
3.2g Na2CO3固体 |
20℃ |
24.3℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL+10ml水 |
20℃ |
24.2℃ |
|
⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
|
⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
①该研究报告的题目是《________________________________________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为_________和__________;通过上述实验可得出五条结论:
a:NaHCO3的溶解是_______(吸热或放热)过程;
b:Na2CO3的溶解是_______(吸热或放热)过程;
c:NaHCO3的饱和溶液和盐酸的反应是____________(吸热或放热)反应;
d:Na2CO3的饱和溶液和盐酸的反应是____________(吸热或放热)反应;
e:NaHCO3固体与稀盐酸反应的反应热是由______(填a→d的字母)的热效应之和。
48.实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
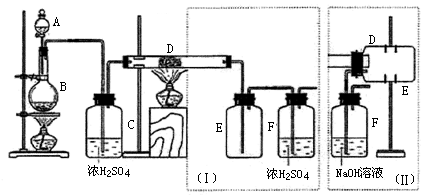
(1)B中反应的化学方程式为:___________________________________________________;
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是:
_______________________________________________________________。
(3)D中反应化学方程式为:________________________________。
(4)装置(Ⅰ)的主要缺点是:
________________________________________________________ 。
(5)装置(Ⅱ)的主要缺点是:_____________________________。
如果选用此装置来完成实验,则必须采取的改进措施是:
__________________________________________________________
47.用下面积几种方法可以制得Fe(OH)2沉淀:
方法1.用不含Fe3+的FeSO4溶液与用不含氧气的用蒸馏水配制的NaOH溶液反应制备,
1).用硫酸亚铁晶体配制上述FeSO4溶液时,还需加入_________________
2).除去蒸馏水中溶解的氧气常采用___________ 的方法。
3).生成白色的Fe(OH)2沉淀的操作是用长滴管吸取不含氧气的NaOH溶液,插入FeSO4溶液下面,再挤出NaOH溶液,这样操作的理由是 _____________________________________.
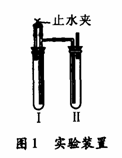 方法2.在如图1的装置中,用NaOH溶液、铁屑,稀硫酸等试剂制备,
方法2.在如图1的装置中,用NaOH溶液、铁屑,稀硫酸等试剂制备,
1)在试管Ⅰ里加入的试剂是______________________________
2).在试管Ⅱ里加入的试剂是____________________________
3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_______________________________
4).这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
______________________________________________
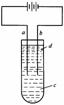 方法3.由于Fe(OH)2极易被氧化,所以实验很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
方法3.由于Fe(OH)2极易被氧化,所以实验很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
(1)a电极材料应为________,电极反应式为_________________________。
(2)电解液c可以是(填编号)__________________。
A.纯水 B.NaCl溶液C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为_________________,在加入苯之前对c应做何
简单处理?_____________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)_________
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减小两电极间距离 D.适当降低电解液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为
____________________________________________。
46.硫酸铜的制备实验是无机化学实验教学中一个必做实验,某研究性学习小组设计了如下两个实验方案:
实验一:
因铜不能与稀硫酸直接反应,实验中以浓硝酸分次加入到铜和稀硫酸的混合液中,加热使之完全反应,通过蒸发、析晶等操作得到硫酸铜晶体。
(1)浓硝酸所起的作用是___________________________________
(2)该反应的原理是(用化学方程式表示)
______________________________________________ 。
实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太小,当升高温度到80-90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
(3)用离子方程式表示速率明显加快的原理
______________________________________________ 。
Fe2(SO4)3的作用是__ 。
(4)得到的混合液用______________调节pH =2-4,使Fe3+形成Fe(OH)3沉淀而除去,且Fe(OH)3可以循环使用。
(5)请根据以上内容,对这两个实验方案进行评价,填下表:
|
|
实 验
一 |
实 验
二 |
|
主要优 点 |
|
|
|
主要缺 点 |
|
|
45. 某兴趣小组同学共同设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质。请回答下列问题:
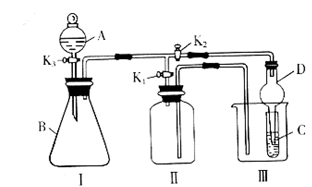

(1) 利用装置Ⅰ制取气体,生成气体的反应应具备的条件是
_________________________________________________________________。
装置Ⅲ中仪器D在实验中的作用是 。
(2)利用Ⅰ、Ⅱ装置制取气体(K2关闭,K1打开)。
甲同学认为:利用Ⅱ装置可以收集H2、NH3等气体,但不能收集O2和NO等气体,其理由是________________________________________________________________________。
乙同学认为:利用Ⅱ装置作简易改进(不改变仪器装置)也可以收集O2和NO等气体,但不能收集SO2等气体,改进的方法是______________________________________________,利用Ⅱ装置再作简易改进(不改变仪器装置)也可以收集SO2等气体,改进的方法是_________________________________________________________。
(3)利用Ⅰ、Ⅲ装置验证物质的性质(K2打开,K1关闭)。如设计实验证明氧化性:
KMnO4>Cl2>Br2则在A中加浓盐酸,B中加__________,C中加________。观察到C中的现象是________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com