
题目列表(包括答案和解析)
15.(8分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。




(1)只根据图I、图II所示实验,能够达到实验目的的是_________(选填“I”或“II)
(2)图III、图IV所示实验均能鉴别这两种物质,其反应的化学方程式为_____________
______________________________________________________________________________,与实验III相比,实验IV的优点是________(填选项序号)
A.IV比III复杂 B.IV比III安全
C.IV比III操作简便
D.IV可以做到用一套装置同时进行两个对比实验,而III不行
(3)若用实验IV验证碳酸钠和碳酸氢碳的稳定性,则试管B中装入的固体最好是_______________________________(填化学式)

|
|
盐的类型 |
实 例 |
参加电解物质 |
溶液pH |
使溶液复原应加入物质 |
|
1、 |
A-C盐 |
Na2SO4 KNO3 |
H2O |
不变 |
H2O |
|
A的碱 |
KOH NaOH |
增大 |
|||
|
C的酸 |
H2SO4 HNO3 |
减小 |
|||
|
2、 |
B-D盐 |
CuCl2 HgCl2 |
电解质 |
不定 |
CuCl2、HgCl2 |
|
D的酸 |
HCl HBr |
增大 |
HCl、HBr |
||
|
3、 |
A-D盐 |
NaCl KBr |
H2O+电解质 |
增大 |
HCl、HBr |
|
4、 |
B-C盐 |
CuSO4 AgNO3 |
减小 |
CuO、Ag2O |
说明: ①阴阳离子在两极上放电顺序复杂,与离子性质、溶液浓度、电流强度、电极材料等都有关,不应将放电顺序绝对化,以上仅是一般规律。 ②电解过程中析出的物质的量(或析出物质的质量):在电解若干串联电解池中的溶液时,各阴极或阳极所通过的电量相等,析出物质的量取决于电路中通过的电量。 2.金属作阳极(Pt除外)时,金属失电子发生氧化反应,阴极上阳离子放电顺序不变。 四.用惰性电极电解电解质溶液的变化情况
|
类 型 |
电极反应特点 |
实 例 |
电 解 物 质 |
电解质溶液的浓 度 |
pH |
电解质溶 液复原 |
|
电解 水型 |
阴极:2H++2e-=H2↑ 阳极:4OH--4e-= O2↑+2H2O |
NaOH |
水 |
增大 |
增大 |
水 |
|
H2SO4 |
水 |
增大 |
减小 |
水 |
||
|
Na2SO4 |
水 |
增大 |
不变 |
水 |
||
|
电解电解质 |
电解质电离出的阴、阳离子分别在两极放电 |
HCl |
电解质 |
减小 |
增大 |
氯化氢 |
|
CuCl2 |
电解质 |
减小 |
增大 |
氯化铜 |
||
|
放H2生碱型 |
阴极:放出氢气生成碱 阳极:电解质阴离子放电 |
NaCl |
电解质和水 |
生成新电解质 |
增大 |
氯化氢 |
|
放O2生酸型 |
阳极:OH-放电生成酸 阴极:电解质阳离子放电 |
CuSO4 |
电解质和水 |
生成新电解 质 |
减小 |
氧化铜 |
注意:
(1)电解水型:含氧酸、强碱、活泼金属的含氧酸盐的电解;
(2)电解电解质型无氧酸(除HF外)、不活泼金属的无氧酸盐(氟化物除外)溶液的电解;
(3)放氢生碱型:活泼金属的无氧酸盐(氟化物除外)溶液的电解;
(4)放氧生酸型:不活泼金属的含氧酸盐溶液的电解;
|
|
电解食盐水 |
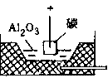
电解Al2O3(熔融态) |
电 镀 |
电解精炼 |
|
装置示意图 |
 |
 |
 |
 |
|
阴极反应 |
2H++2e-=H2↑ |
4Al3++12e-=4Al |
Zn2++2e-=Zn |
Cu2++2e-=Cu
(精铜) |
|
阳极反应 |
2Cl--2e-=Cl2↑ |
6O2--12e-=3O2↑ |
Zn-2e-=Zn2+ |
Cu-2e-=Cu2+
(粗铜) |
|
电解总反应 |
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑ |
2Al2O3 4Al+3O2↑ 4Al+3O2↑ |
- |
- |
|
说 明 |
(1)阴极室与阳极室应用隔膜分开。
(2)食盐水需经净化,除Mg2+、Ca2+、SO42-等离子。 |
(1)为降低Al2O3熔点,需加助熔剂(冰晶石)。
(2)阳极生成的O2与碳反应,生成CO2,需要定期更换石墨阳极。电解生成的铝积存在槽底,定期汲出。
(3)实际过程复杂,上述反应仅是粗略的表示 |
(1)镀件必须作阴极。
(2)镀层金属作阳极。
(3)用含镀层阳离子的溶液作电镀液。 |
(1)粗铜作阳极,溶解下来。
(2)精铜作阴极。 |
|
|
原电池 |
电解池 |
|
能量转化 |
化学能→电能 |
电能→化学能 |
|
反应特征 |
自发进行的氧化还原反应 |
非自发进行的氧化还原反应 |
|
电极名称 |
由电极本身决定
负极:相对较活泼金属
正极:相对不活泼金属 |
由电源决定
阴极:与负极相连
阳极:与正极相连 |
|
电极反应 |
负极:氧化反应
正极:还原反应 |
阴极:还原反应
阳极:氧化反应 |
|
装置特征 |
无电源,两极不同 |
有电源,两极可以相同,也可以不同 |
|
电子流动方向 |
 |
|
|
溶液中离子流向 |
阳离子移向正极
阴离子移向负极 |
阳离子移向阴极
阴离子移向阳极 |
|
联 系 |
两者均发生氧化还原反应 |
29.工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7% O2 11% N2 82%);

(1)已各SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量 (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)  2SO3(g);△H=-196.9kJ·mol-1,计算每生产1
2SO3(g);△H=-196.9kJ·mol-1,计算每生产1
万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
28.(2004,全国卷)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都有是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则,
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
 ②Y电极上的电极反应式为 ,检验该电极反应产物的方法是
。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是
。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
27.(1998年上海-31)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下

依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为_____
,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
、 。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42--,该钡试剂可以
是 (选填a,b,c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选填a、b、c多选扣分)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、
(填写操作名称)除去NaCl
(6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO 和H2,相应的化学方程式为 。
26. (2003年春季)如图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为X、Y。
(2003年春季)如图是可用于测量阿伏加德罗常数的装置示意图,其中A、B是两块纯铜片,插在CuSO4稀溶液中,铜片与引出导线相连,引出端分别为X、Y。
⑴ 当以I=0.21A的电流电解60min后,测得铜片A的质量增加了0.25g,则图装置中的X端应与直流电的 极相连,它是电解池的 极。
⑵ 电解后铜片B的质量 (答“增加”、“减少”或“不变”)。
⑶ 列式计算实验测得的阿伏加德罗常数NA。(已知电子电量e=1.60×10–19C)
25.由于Fe(OH)2极易被氧化,所以实验很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。
 (1)a电极材料应为________,电极反应式为_________________________。
(1)a电极材料应为________,电极反应式为_________________________。
(2)电解液c可以是(填编号)__________________。
A.纯水 B.NaCl溶液C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为_________________,在加入苯之前对c应做何
简单处理?_____________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)_________
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减小两电极间距离 D.适当降低电解液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为
____________________________________________。
24.现有Cu2+、Cl― 、Na+、SO42―、Zn2+ 两两组成的电解质溶液若干种,可选用铜电极、铂电极、锌电极进行电解实验。
(1)以铜为阳极电解_________或____________溶液,均可得到氢氧化物沉淀。
(2)要使电解过程中溶质的组成和质量不变,而溶液浓度增大,又 无浑浊,应以__________为阳极电解_____________溶液,化学方程式为_______________________。
(3)要使电解过程中溶液浓度改变,而溶剂质量不变,应以铂电极为阳极电解_____________溶液,或以___________为阳极电解________溶液,反应的化学方程式是____________________________________。
(4)使反应Cu+2H2O==Cu(OH)2 ↓+H2 ↑ 得以进行而不发生其它反应,可选用______________为阳极电解__________或____________溶液
(5)。以铜为阳极电解ZnSO4溶液,阴极上一般有___________逸出,在________极区首先会有__________色沉淀,电解时间较长时,会有______色沉淀出现。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com