
题目列表(包括答案和解析)
1.“5.12”汶川大地震后,没有出现大的疫情,各种消毒剂的作用功不可没。下列物质不能用作饮用水的消毒剂的是
 A.Cl2
B. -OH
C.O3 D.ClO2
A.Cl2
B. -OH
C.O3 D.ClO2
21.(10分)取一根镁条置于坩埚内完全燃烧,得到氧化镁和氮化镁混合物总质量0.470 g,冷却后加入适量盐酸溶解恰好反应生成两种盐的混合溶液,且无任何气体放出。向溶液加入氨水,直到Mg2+恰好完全沉淀。然后将坩埚加热蒸干并灼烧至质量不再改变,剩余固体总质量为0.486 g。
(1)写出氮化镁与盐酸反应的化学反应方程式__________________________________。
(2)蒸干灼烧坩埚的过程中产生的物质中常温下为气体有__________________________,
产生上述气体的化学方程式为____________________________________________________。
(3)燃烧所得混合物中氮化镁的质量分数为____________________________________。
20.(14分) 为测定工业烧碱的纯度,准确称取10.00g样品(含 杂质),配制成1000mL溶液。用0.20 mol/L的盐酸标准溶液进行滴定。
杂质),配制成1000mL溶液。用0.20 mol/L的盐酸标准溶液进行滴定。
(1)量取10.00mL上述烧碱溶液,加入2-3滴酚酞试液做指示剂,移至酸式滴定管下进行滴定,当达到终点时消耗盐酸为_______mL(按图推算),此时烧碱溶液的物质的量浓度为________mol/L,通过计算,工业烧碱中 的质量分数为_____%。
的质量分数为_____%。
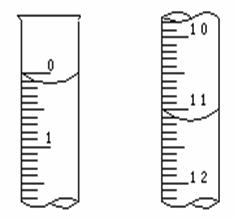
(2)若滴定前酸式滴定管用蒸馏水洗净后,未用盐酸标准溶液润洗,测定结果将会__________(偏高、偏低、无误差);若滴定前酸式滴定管尖咀部分未充满溶液,测定结果将会_______(偏高、偏低、无误差)。
(3)如果实验室仅提供托盘天平一种量具,其它仪器,药品自选,测定该工业烧碱的纯度。简述你设计的实验(只要求写出实验原理,不必填写详细实验步骤):
__________________________________________________________________________________。
19. (12分)A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出。表中的内容分别为符合相互转化关系的四种情况,请按要求完成填表。
(12分)A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出。表中的内容分别为符合相互转化关系的四种情况,请按要求完成填表。
|
|
已知信息 |
符合题意的问题答案(若有多组,只写一组) |
|
(1) |
①②③均为水溶液中的置换反应,A、D、E为卤素单质 |
A、D、E氧化性:(填物质化学式) ____ >____> ____ |
|
(2) |
若B是水,C是一种铁的氧化物,E是一种无色能与血红蛋白结合的气体 |
反应①的化学方程式: _____________________________________。 F分子的空间结构为___________。 |
|
(3) |
若B为淡黄色固体粉末,A是一种无色液体,E是一种常见气体,D是单质 |
反应③的化学方程式: _____________________________________。 B的电子式为____________。 |
|
(4) |
若A是常见的两性化合物,C的焰色反应显黄色,D是水,E为强酸溶液 |
物质C水解的离子方程式为 _____________________________________。 |
18.(8分) (1)在反应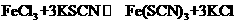 中,由于生成难电离的
中,由于生成难电离的 而溶液变为红色。
而溶液变为红色。
①向溶液中分别加入少量下列物质的浓溶液,能够使平衡向正反应方向移动,且红色加深的有_____________________(多选少选均不得分)
A. B.
B. C.
C. D.
D. E.
E.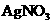
 ②根据勒夏特列原理,在溶液的平衡体系中加水稀释,平衡向着溶质微粒个数增多的方向移动。在上述反应达到平衡的溶液中,t1时刻加入一定量的水稀释,请在图上标出t1时刻及之后的正逆反应速率变化曲线。
②根据勒夏特列原理,在溶液的平衡体系中加水稀释,平衡向着溶质微粒个数增多的方向移动。在上述反应达到平衡的溶液中,t1时刻加入一定量的水稀释,请在图上标出t1时刻及之后的正逆反应速率变化曲线。
(2)在某条件下,容器中有如下平衡反应 。此时,A、B、C的物质的量均为amol,而D的物质的量为d mol。
。此时,A、B、C的物质的量均为amol,而D的物质的量为d mol。
①改变a的取值,再通过改变反应条件,可以使反应重新达到平衡,并限定达到新的平衡时,D的物质的量只允许在d/3到3d之间,则a的取值范围是
(用a和d的关系式表示)。
②如果要使本反应重新建立的平衡中,D的物质的量只允许在d到3d之间取值,
应该采取的措施是 (从下面选项中选取,多选少选均不给分)
A.升高反应温度 B.降低反应温度
C.增大反应容器内的压器 D.减少反应容器内的压强
E.增大反应容器的容积 F.减少反应容器的容积
17.(8分)常温下有A、B、C、D四种无色溶液,它们分别是 溶液、
溶液、 溶液、盐酸和
溶液、盐酸和 溶液中的一种。已知A、B中水的电离程度相同,A、C的pH相同,据此推断
溶液中的一种。已知A、B中水的电离程度相同,A、C的pH相同,据此推断
(1)D是 (写化学式)
(2)若B溶液中c(OH-)与C溶液中c(H+)相同,则B溶液的pH(用pHB表示)与C溶液的pH(用pHC表示)的关系式为 ;
(3)实际配制A溶液时,是将A固体溶于一稀溶液E中,E是 ,这样处理的目的是 。
16. 常温下将pH = 3的 溶液V1 mL
与pH =11的
溶液V1 mL
与pH =11的 溶液V2 mL混合,下列不正确的是
溶液V2 mL混合,下列不正确的是
A.若反应后溶液呈中性,则c (H+) + c (OH―) = 2×10―7mol/L
B.若V1 = V2 ,反应后溶液的pH可能等于7
C.若反应后溶液呈酸性,则V1 一定大于 V2
D.若反应后溶液呈碱性,则V1 一定小于 V2
15. 铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480 mL的 气体和336 mL的
气体和336 mL的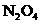 气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A. 9.02g B. 8.26g C. 8.51g D. 7.04g
14.现有下列四个图像,下列反应中全部符合以下图像的反应是:

A.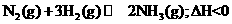
B.
C. D.
D.
13. 一定温度下的可逆反应: 。现将2mol A和2molB充入体积为V的甲容器,将2 molC和6mol D充入体积为2V的乙容器。关于两容器中反应的说法一定正确的是
。现将2mol A和2molB充入体积为V的甲容器,将2 molC和6mol D充入体积为2V的乙容器。关于两容器中反应的说法一定正确的是
A.甲容器中的反应先达到化学平衡状态
B.反应达到平衡时,两容器中各组份的体积分数相同
C.两容器达平衡后升高相同的温度,达到新的平衡,甲乙容器中平衡混合物中各组份的体积分数不同
D.在甲容器中再充入2 mol A和2 mol B,平衡后物质C的浓度甲与乙相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com