
题目列表(包括答案和解析)
1.Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖,关于NO的下列叙述不正确的是
A.NO可以是某些含低价N物质氧化的产物 B.NO不是亚硝酸酐 C.NO可以是某些含高价N物质还原的产物 D.NO是红棕色气体
21.(8分)0.5molX元素的离子被还原成中性原子时,需要得到6.02×1023个电子;0.4gX元素的单质与足量盐酸充分反应后放出0.02g氢气。X元素原子的质量数和中子数相等,短周期元素Y的气态氢化物HY的水溶液是实验室中常用的强酸之一。
⑴①X元素的相对原子质量为______,质子数为______,名称是______。
②Y元素的名称是______,位于元素周期中的第______周期______族。
⑵用化学方程式表示X元素的最高价氧化物对应的水化物元素的单质在常温下的反应:____________________________________________________。
20.(7分)多原子分子(CN)2、(SCN)2和(OCN)2的性质与卤素单质相似,故称他们为类卤素,他们可以生成酸和盐(见下表,表中X代表F 、Cl、Br或I)。
|
|
卤素 |
氰 |
硫氰 |
① |
|
“单质” |
X2 |
(CN)2 |
(SCN)2 |
(OCN)2 |
|
酸 |
HX |
HCN |
② |
HCNO |
|
盐 |
KX |
KCN |
KSCN |
③ |
⑴在表中①、②、③的空格处分别填写的名称或化学式是
______、______、______。
⑵完成下列反应的化学方程式或离子方程式。
①(CN)2 和KOH溶液反应的化学方程式为
________________________________________________ 。
②已知阴离子的还原性为:Cl ---<Br ---<CN ---<SCN ---<I ---。
试写出在NaBr和KSCN的混合溶液中加入(CN)2时离子方程式:__________________________________________________。
19.(11分)下表为元素周期表的一部分,回答下列有关问题:
|
周期 族 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
ⅧA |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
③ |
④ |
⑤ |
⑥ |
|
⑦ |
⑧ |
⑨ |
|
4 |
⑩ |
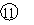 |
|
|
|
|
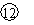 |
|
⑴ 写出元素符号:①___________,④___________。
⑥____________,⑦__________。
⑵若用M代表碱金属元素,则其最高价氧化物对应的水化物
的化学式为______________;若X表示卤族元素,则其气态氢
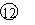 化物的分子式为______________;元素②、⑧、 的气态氧化物
化物的分子式为______________;元素②、⑧、 的气态氧化物
稳定性由强到弱的顺序为______>______>______(填化学式)。
⑶在元素③和⑩中化学性质较活泼的是______(填元素符号),写出用化学实验证明它较活泼的方法:________________________________________。
18.(10分)某学生在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象。
现在请你帮助该学生整理并完成实验报告。
⑴实验目的:_______________________ 。
⑵实验用品:
仪器:试管、胶头滴管。
药品:氯水、溴水、氯化钠溶液、碘化钾溶液、四氯化碳
⑶实验内容(在下表横线中填写有相关内容):
|
序号 |
实验方案 |
实验现象 |
|
⑴ |
向盛有少量溴化钠溶液的试管中 滴加少量的新制的氯水,振荡, 在注入少量四氯化碳,振荡后静置。 |
液体分为两层,下层是 _______色 |
|
⑵ |
向盛有少量碘化钾溶液的试管中 滴加少量溴水,振荡, 在注入少量四氯化碳,振荡后静置 |
液体分为两层,下层是 _______色 |
⑷
实验结论:_______________________________ 。
⑸问题和讨论:
① 上述两个实验中发生的反应的离子方程式分别为:
_____________________________、__________________________________。
②由于F2过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯强:_________________________________________________________________、_________________________________________________________________
17.(7分)在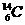 、
、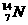 、
、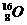 、
、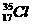 、
、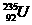 、
、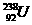 中:
中:
⑴__________和__________互为同位素。
⑵_________和__________的质量数相等,但不能互称为同位素。
⑶_________和__________的中子数相等,但质子数不相等,所以不是同一种元素。
以上所列共有_______种元素。
16.无机化学命名委员会(国际组织)在1989年作出规定:把长式周期表原先的主、副族及族号取消,由左到右改为18列,如氢和碱金属元素为第1列,稀有气体元素为第18列。按此规定,下列说法中错误的是 ( )
A.第9列元素中没有非金属元素
B.只有第2列元素原子的最外层电子数为2
C.第18列元素的单质在常温常压下均为气体
D.在18列元素中,第3列元素的种类最多
第Ⅱ卷 (非选择题 共52分)
15.已知溴易挥发,碘易升华。现向含有NaBr和KI的混合溶液中通过过量的氯气,充分反应后将溶液蒸干,并灼烧所得物质,最后剩余的固体是 ( )
A.NaCl和KI B.NaCl、KCl和I2
C.KCl和NaBr D.KCl和NaCl
14.下列叙述中正确的是 ( )
A.发生化学反应时,失去电子越多的金属原子,其还原能力越强
B.目前已发现112种元素,即已发现112种核素
C.核外电子总数相同的原子,一定是同种元素的原子
D.按原子序数增加的顺序,碱金属元素的金属性和卤素的非金属性和递变规律完全一致
13.钾的还原性比钠强,原因是 ( )
A.钾的相对原子质量更大
B.钾可失去的电子更多
C.钾原子含有的电子更多
D.钾原子与钠原子的最外层都只有1个电子,但钾原子半径更大,易失去电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com