
题目列表(包括答案和解析)
6.下列溶液:①酚酞试剂②银氨溶液③Na2CO3溶液④氢氧化铜悬浊液⑤酸化的FeCl3溶液其中不宜在实验室里长期放置,应在使用时配制的是 ( )
A.②④ B.②③④⑤ C.②③④ D.①②③④⑤
5.进行化学实验必须注意安全,下列说法不正确的是 ( )
A.不慎将酸溅到眼中,应立即用水冲洗,并且边洗边眨眼睛
B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
C.如果苯酚溶液沾到皮肤上,应立即用酒精擦洗
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸中
4.过氧化氢的沸点比水高,但受热容易分解。某试剂厂先制得7%~8%的过氧化氢溶液,再浓缩成30%的溶液时,可采用的适宜方法是 ( )
A.常压蒸馏 B.减压蒸馏 C.加生石灰常压蒸馏 D.加压蒸馏
3.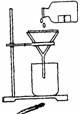 某学生发现滴瓶中溶液里有悬浊物,拟用右图所示操作进行过滤,错误的
某学生发现滴瓶中溶液里有悬浊物,拟用右图所示操作进行过滤,错误的
操作用 ( )
A.5处 B.4处
C.3处 D.2处
2.下列实验操作中,仪器的下端需插入液面下的有①制备 Fe(OH)2用胶头滴管将NaOH溶液滴入FeSO4溶液中;②制备氢气的简易装置中的长颈漏斗;③分离石油时控制温度所使用的温度计;④用乙醇制备乙烯时所用的温度计;⑤用水吸收氨气时的导气管;③向试管中的BaC12溶液中滴加稀硫酸 ( )
A.③⑤⑥ B.②⑤ C.①②④ D.①②③④⑤⑥
1.洪涝地区欲将江河水转化为可饮用水,下列处理过程较合理的是 ①化学沉降(用明矾);②消毒杀菌(用漂白粉);③自然沉降;④加热煮沸 ( )
A.③①②④ B.①③②④ C. ①②③④ D.③②④①
 21(A)聚合铁(简称PFS)化学式为:
21(A)聚合铁(简称PFS)化学式为: 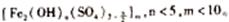 现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。
现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。
(l)①PFS中铁显 价,铁原子的电子排布式是 。 ②O元素的第一电离能 N 元素的第一电离能(填“大于”或“小于”) ,原因 ;水分子中氧原子的杂化轨道类型为 。H2O与H+以配位键结合成H3O+的立体结构为 。
(2)水在不同的温度和压力条件下可以形成11种不同结构的晶体,密度从比水轻的0.92g/cm3扩到约为水的一倍半。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰一VII的晶体结构为一个如右上图所示的立方晶胞,每个水分子可与周围 个水分子以氢键结合,晶体中,1mol水可形成 mol氢键。
(3)已知下列元素的电负性数据:H: 2.1, O: 3.5, F:4.0。OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
21、 (B)
(B)
全属镁具有很强的还原性,点燃的镁条能在氨气中剧烈燃烧,发生如下反应:
①Mg+2NH3-点燃→Mg(NH2)2+H2
②Mg+NH3-点燃→MgNH+H2
(1)如上图装置A所示,镁条在HN3中燃烧时,先落下的残渣主要是Mg(NH2)2,后落下的残渣主要是MgNH。其原因是_____________________________。
(2)为了使残渣中Mg(NH2)2生成得更多,可以在镁条燃烧前打开弹簧夹a,并将导管与充满_____气体的装置B连接,连接的导管接口为________(填编号“b”或“c”),理由是_____________
(3)将固体残渣在盛有水的烧杯中加热至沸腾后,Mg(NH2)2和MgNH完全水解,产生Mg(OH)2和NH3。为了确保Mg(NH2)2和MgNH全部转化为Mg(OH)2,加热过程中必要的操作是___________________。
(4)将沉淀过滤、洗涤、烘干后,称得Mg(OH)2的质量为0.435g。又测得装置B中剩余气体的密度为氢气的10倍,体积为224ml(以上数据均折算成标准状况)。由此可推算出残渣中各物质的量之比 =___________________________。然而将上述镁带燃烧过程在相同情况下重复多次。固体残渣中实际所得Mg(NH2)2和MgNH的物质的量之比总是小于该值,分析可能的原因是______________________________________________________。
=___________________________。然而将上述镁带燃烧过程在相同情况下重复多次。固体残渣中实际所得Mg(NH2)2和MgNH的物质的量之比总是小于该值,分析可能的原因是______________________________________________________。
20、磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
|
成分 |
CaO |
P2O5 |
SO3 |
CO2 |
|
质量分数(%) |
47.30 |
28.40 |
3.50 |
6.10 |
(1)磷灰石中,碳元素的质量分数为___________%(保留两位小数)。
(2)取100 g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4_________________g(保留两位小数)。
(3)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1 mol/L)与其反应,结果Ca、S、P元素全部以CaSO4 和Ca(H2PO4)2 的形式存在,求m的值。
(4)若工厂用磷灰石中Ca3(PO4)2 为原料同时生产H3PO4和Ca(H2PO4)2 ,市场上1mol H3PO4的利润是a元,1 mol Ca(H2PO4)2的利润是b元。由100 mol原料Ca3(PO4)2 制得的二种产品的利润共为y元,产品H3PO4和Ca(H2PO4)2的物质的量之比
 =x,试求y与x的关系式。
=x,试求y与x的关系式。
19、磺胺类药物,常用于肠道抗菌感染的治疗,工业上可用苯为原料通过下列反应制得磺胺。(转化关系中-H2O、-HCl、-CH3COOH分别表示反应中有H2O、HCl、CH3COOH生成)
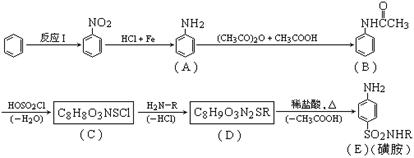
①反应Ⅰ的反应类型是________反应。
②分析上述反应过程中所提供的有关信息,写出C的结构简式:________________________。
③写出D-→E的化学方程式:
_______________________________________________________________________________
18、A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体。甲、乙、丙为常见的化合物,甲物质具有磁性。它们之间有如图19所示的转化关系:
错误!嵌入对象无效。
请回答下列问题:
(1)B与甲反应的化学方程式是 。
B与NaOH溶液反应的离子方程式是 。
(2)含有B形成的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式是 。
(3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是 。
 (4)电浮选凝聚法是工业上采用的一种污水处理方法,图20
(4)电浮选凝聚法是工业上采用的一种污水处理方法,图20
是该方法处理污水的实验装置示意图,实验过程中,污
水的pH始终保持在5.0~6.0之间。接通电源后,阴极产
生的气体污物带到水面形成浮渣而刮去,起到浮选净作
用;阳极产生的沉淀具有吸附性,吸附污物面沉积,起到
凝聚净化作用。阳极的电极反应分别是 、
2H2O-4e-=4H++O2↑;
阳极区生成沉淀的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com