
题目列表(包括答案和解析)
7.下列叙述正确的是 ( )
①氯气的性质很活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
6.4℃时,25滴水为amL,则1滴水中含有的水分子数为 ( )
A.aNA/25 B.aNA/(25×18) C.aNA/(25×20) D.aNA/(1000×22.4)
5.对于反应XeF4 + 2CH3CH = CH2→2CH3CH2CHF2 + Xe下列说法正确的是 ( )
A.XeF4被氧化 B.CH3CH = CH2是还原剂
C.该反应是非氧化还原反应 D.XeF4既是氧化剂又是还原剂
4.金属铜的提炼多从黄铜矿开始。黄铜矿在焙烧过程中主要反应之一的化学方程式为:
2CuFeS2 + O2 = Cu2S + 2FeS + SO2,下列说法不正确的是 ( )
A.O2只做氧化剂
B.CuFeS2既是氧化剂又是还原剂
C.SO2既是氧化产物又是还原产物
D.若有1molO2参加反应,则有4mol电子转移
3.下列反应不属于吸热反应的是 ( )
A.氢气还原氧化铜 B.高锰酸钾分解
C.锌放入稀硫酸中 D.碳和水蒸气在高温下反应
2.将一定量氯气通入溴化亚铁溶液中后,再加入四氯化碳振荡、静置,整个实验中,肯定可以观察到的现象是 ( )
A.四氯化碳层呈红棕色 B.水层呈黄色
C.四氯化碳层无色 D.在潮湿空气中形成白雾
1.在水溶液中或在液态时导电能力都非常强的是 ( )
A.NaCl B.蔗糖 C.H2SO4 D.CaSO4
23.(8分)
燃烧1.00t含硫质量分数为48.0%的黄铁矿矿石,若在生产过程中,黄铁矿的利用率为90.0%,硫酸的产率为85.0%,且还有质量分数为1.50%的硫留在炉渣里。试计算能够生产多少吨H2SO4质量分数为98.0%的硫酸。
22.(14分)
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。
[方案I](1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的溶液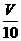 mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式 。
[方案III](1)称取碳酸钙样品 M g;
(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”?
;
问题2:本方案中的“冷却”应如何操作
。
[方案IV](1)称取碳酸钙样品 M g;
(2)加入足量Cmol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量C′mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.C、V B.C′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′ mL
B.精确配制浓度C′mol/LNa2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钠纯度将
(偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
。
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案 ; 。
方案 ; 。
21.(10分)
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)右图是一个电化学过程示意图。
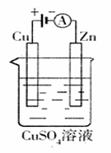 ①锌片上发生的电极反应是
①锌片上发生的电极反应是
②假设使用肼-空气燃料电池作为本过程中的电源,
铜片的质量变化128g,则肼一空气燃料电池理论上
消耗标标准状况下的空气 L(假设空气中
氧气体积含量为20%)
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的
稀溶液。该反应的离子方程式是 。
 (4)1998年希腊亚里斯多德大学的Marnellos和Stoukides
(4)1998年希腊亚里斯多德大学的Marnellos和Stoukides
采用高质子导电性的SCY陶瓷(能传递H+),实现了
高温常压下高转化率的电化学合成氨。其实验装
置如图。阴极的电极反应式为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com