
题目列表(包括答案和解析)
21.(8分)在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
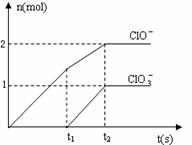
⑴t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为_____________________________。
⑵该石灰乳中含有Ca(OH)2的物质的量是_______ mol。
⑶ 据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后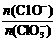 2(填“>”、“<”或“=”);
2(填“>”、“<”或“=”);
若 ,则n(C1-)= mol(用含a的代数式来表示)。
,则n(C1-)= mol(用含a的代数式来表示)。
江苏省宿迁中学2009届高三年级第一次考试
20.(10分)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目:
______________________________________________________________________。
若反应中生成0.2 mol HNO3,转移的电子数目为______________________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是_________________________________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有______________(填化学式)。
19.(12分)位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式 , ,
, 。
(2)C与D形成D的最低价化合物的电子式:______
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因:______ 。
18.(14分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和
实验现象:

请回答:
⑴ 出A、B和C的化学式:A_______________,B______________,C____________。
⑵ 依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
___________________________________________ _;
___________________________________________ _。
⑶将SO2气体通入D溶液,D溶液变为无色,生成两种酸。写出反应的离子方程式:
__________________________________________ _。
⑷ 写出由F→H的化学方程式:
_____________________________________ _______。
17.(8分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。
现有一氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是____________,化合价没有发生变化的反应物是______________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平)。
________________________________________________________。
(3)上述反应中,氧化剂是______________,1 mol氧化剂在反应中_________(填“得到”或“失去”)___________mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:_________________________________________。
16.(8分)现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离。相应的实验过程可用下图表示:


(1) 写出上述实验过程中所用试剂的名称:
试剂1___________试剂2_____________试剂4________________
(2)恰当地控制试剂4的加入量的方法是_________________________________
(3)加入过量试剂3的目的是_______________________________
(4)在加入试剂4后,获得固体D的实验操作④是_____________________(填操作名称)
15.(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O
NH4HCO3 ; NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
 2NaHCO3 Na2CO3+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
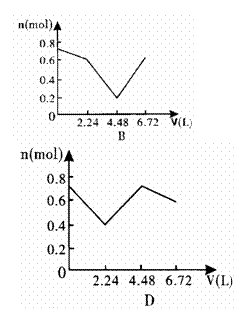
14.向含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入6.72L(已换算成标准状况)CO2气体。下列表示溶液中离子的物质的量与通入CO2的体积关系的图象中,符合题意的是(气体的溶解和离子的水解都忽略不计)

第Ⅱ卷(非选择题,共72分)
13.下列各溶液中,各离子可能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.滴加无色酚酞试液后变红色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
C.pH为1的溶液:Ca2+、I-、Mg2+、NO3-
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、HCO3-
12.下列反应的离子方程式正确的是
A.Cu和稀硝酸反应:3Cu + 8H+ + 2NO3- △ 3Cu2+ + 2NO↑+ 4H2O
B.氢氧化镁与稀硫酸反应:H+ + OH- = H2O
C.Ca(HCO3)2溶液与过量的NaOH溶液反应:
Ca2+ + 2HCO3- +2OH- = CaCO3↓+ CO32- + 2H2O
D.等物质的量浓度、等体积的NH4HCO3溶液与NaOH溶液相混合:
NH4+ + HCO3- + 2OH- = NH3·H2O + CO32- + H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com