
题目列表(包括答案和解析)
8、有分子参加的化学反应前后,一定发生改变的是( )
A.分子种类 B.原子种类 C.原子个数 D.原子量
7、下列有关分子和原子的叙述中,错误的是( )
A.分子和原子都处于永恒的运动状态
B.分子和原子都是构成物质的微粒
C.分子和原子都是保持物质化学性质的最小微粒
D.分子和原子都可以再分
6、分子和原子的主要区别是( )
A.分子是构成物质的微粒,原子不是构成物质的微粒
B.分子质量都大于原子质量
C.分子永恒运动,原子在分子中是不运动的
D.分子在化学反应中可分,原子在化学反应中不能再分
5、最早发现电子的科学家是( )
A.汤姆生 B.道尔顿 C.拉瓦锡 D.阿伏加德罗
4.在化学变化中必然会发生改变的是( )
A、分子的种类 B、原子的种类和数目
C、原子核内的质子数 D、原子的质量和性质
3.下列变化中,构成物质的分子本身发生变化的是( )
A、糖溶于水
B、衣箱中樟脑丸不久不见了
C、工业上蒸发液态空气制氧气
D、白磷自燃
2.对分子的叙述,正确的是( )
A、分子是构成物质的惟一粒子
B、由分子构成的物质,保持物质性质的是分子
C、同种物质的每一个分子化学性质都相同
D、分子的大小会随着物质的体积增大而变大
1. 能闻到花香的原因是( )
A、分子有质量 B、分子间有间隔
C、分子在不断运动 D、分子体积小
6、原子的结构

注意:
(1)核电荷数=质子数=核外电子数
即原子核所带的电量与核外电子所带的电量相等,电性相反,所以整个原子不显电性。
(2)同一类原子,核电荷数即质子数相同。不同类原子,核电荷数即质子数不同。 (3)原子核内质子数不一定等于中子数。如铁原子中,质子数为26,中子数为30。
(4)并不是所有的原子中都存在中子。最常见的氢原子(普通氢原子)原子核内只有1个质子,却没有中子。 (5)因原子核外电子的质量很小,可忽略不计,所以原子的质量主要集中在原子核上,又因为原子核的体积很小,所以其密度特别大。 (6)原子核的性质:位于原子中心,体积极小,却几乎集中了原子全部的质量,每个原子只有一个原子核,原子核所带的正电荷数目简称为核电荷数。核电荷数决定了原子的种类。7、相对原子质量 (1)国际上是以一种碳原子(碳12,其原子核内有6个质子和6个中子)的质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,就是这种原子的相对原子质量。 (2)相对原子质量与原子实际质量的换算公式: 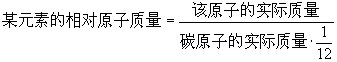 (3)相对原子质量是一个比值,国际单位制单位为1,一般不写出。 (4)相对原子质量越大,则该原子的实际质量也越大。 (5)近似相对原子质量=质子数+中子数
(3)相对原子质量是一个比值,国际单位制单位为1,一般不写出。 (4)相对原子质量越大,则该原子的实际质量也越大。 (5)近似相对原子质量=质子数+中子数
(6)作为相对原子质量标准的碳原子是一种有6个质子和6个中子的碳原子,也证明碳原子不止一种。例如还有质子数为6,中子数为8的碳原子,这些知识将在高中学习。
典型例题讲解
例1 下列物质中,前者属于纯净物,后者属于混合物的是( )
A.净化后的空气、氧化镁
B.水和冰混合、澄清石灰水
C.生锈的铁钉、高锰酸钾充分加热后的剩余固体
D.氯化钾、液氧
思路点拨:
本题将纯净物和混合物的概念组合考查,构造发散。
净化后的空气只除去了空气中的灰尘等杂质,仍属于混合物,(A)错;水和冰混合,因为只存在一种水分子,是纯净物,只是水和冰的状态不同,澄清石灰水是氢氧化钙[Ca(OH)2]溶液,属于混合物,(B)符合题意;生锈的铁钉是混合物,液氧是纯净物,(C)、(D)均不合题意。
解答:选B。
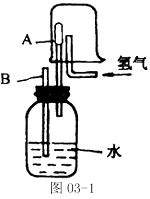
例2 已知在相同的温度下,气体分子的运动速度与分子的质量有关,相对分子质量越大,运动速度越慢。在图03-1中,容器A(器壁能允许气体分子通过)里充满了空气,当烧杯中充满氢气,并连续地通入氢气时,导管B处发生的现象是__________,产生这种现象的原因是____________。
思路点拨:
题中给出的信息“气体分子的运动速度与分子的质量有关,相对分子质量越大,运动速度越慢”。结合分子运动论知识,分子是在永不停息地做无规则运动,而A筒壁允许气体分子通过,氢气比空气的相对分子质量小,运动速度快,那么单位时间内进入A筒的氢气分子比逸出的空气分子多,使A中的气压大于外界大气压,因此,B管中有水喷出。
解答:有水喷出;进入A筒的氢气分子数比逸出的空气分子多,使A中的气压大于外界大气压,从而将广口瓶里的水从B管处压出,故看到B管有水喷出。
例3 对原子量的叙述:①原子量是以碳原子质量的1/12作为标准的;②原子量是以原子核内有6个质子和6个中子的那种碳原子质量的1/12作为标准的;③原子量就是以克作单位的一个原子的质量;④原子量只是一个比值,它是有单位的;⑤原子中决定原子量的微粒数是质子数和中子数。其中正确的是( )
A.①和③ B.②④和⑤ C.①③和⑤ D.②和④
思路点拨:
原子量不是原子的实际质量,它是有单位的;作为原子量标准的,是原子核内有6个质子和6个中子的那种碳原子(碳-12)质量的1/12,自然界中还存在另一种碳原子,它的原子核是由6个质子和7个中子构成的。这种碳-13原子不能用作原子量标准,叙述①笼统地说用碳原子质量的1/12作标准,显然是不正确的;原子的质量集中于原子核,所以,核内质子数和中子数是决定原子量的微粒。所以选项正确的有②、④、⑤。
解答:B
例4 在分子、原子、质子、中子、电子、原子核、离子这些微粒中:
(1)能直接构成物质的微粒有_________________;
(2)能保持物质化学性质的微粒有_____________;
(3)显示电中性的微粒有__________________;
(4)带正电的微粒有______________________;
(5)带负电的微粒有______________________;
(6)质量最小的微粒有_____________________;
(7)参加化学反应时,一定发生变化的微粒有__________;
(8)在同一原子里数目相等的是_____________;
(9)质量与氢原子质量近似相等的是____________。
思路点拨:
本题综合考查微观粒子的性质,思考容量大,解题的关键在于把各种微粒性质的异同点搞清楚。(1)能直接构成物质的微粒有分子(如氧气)、原子(如金属铜)和离子(如食盐NaCl);(2)能保持物质化学性质的微粒当然也包括分子、原子、离子、而分子只是保持物质化学性质的一种微粒;(3)分子、原子不显电性,而中子本身就不带电;(4)质子和原子核带正电荷,离子有阴离子和阳离子之分,其中阳离子带正电荷;(5)电子和阴离子带负电荷;(6)质量最小的微粒应为电子;(7)化学变化时分子一定要解离成原子,再重新结合成其他物质的分子;(8)原子之所以不带电,是因为带正电的质子与带负电的电子数目相等;(9)氢原子的相对质量为1,而中子和质子的相对质量也近似为1。
解答:(1)分子、原子、离子;(2)分子、原子、离子;(3)分子、原子、中子;
(4)原子核、质子、阳离子;(5)电子、阴离子;(6)电子 (7)分子 (8)质子和电子;(9)质子、中子;
例5 原子R核外有26个电子,核内有30个中子,它的质子数为_______相对原子质量约为______。
分析:
此题是根据原子的核电荷数=质子数=核外电子数,相对原子质量=质子数+中子数,这两个关系。已知R原子核外有26个电子,则核内应有26个质子。又因核内有30个中子,所以相对原子质量约为56。
答案:见分析。
例6 碳-12原子的质量为1.993×10-26kg,某原子的相对原子质量是80,则该原子的质量是______kg。
分析:
本题考查的是原子的质量和相对原子质量关系的计算。解题的关键是要搞清原子的质量和相对原于质量二者的区别和联系。
(l)相对原子质量不是原子的实际质量,而是一个比值。
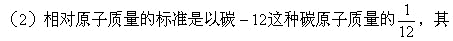
它原子的质量跟它相比较所得的比值就是该种原子的相对原子质量。

某原子的相对原子质量为80,则该原子的质量为:1.66×10-27×80=1.328×10-25(kg)
答案:见分析。
学习时应注意的问题
CuSO4·5H2O是混合物吗?
有很多同学把CuSO4·5H2O当成混合物看待。造成这一错误的原因是认为硫酸铜晶体这一物质由无水硫酸铜和水这两种物质组成。CuSO4·5H2O是一种结晶水合物(严格说来应称“化学式”)。根据科学实验测定,每个硫酸铜分子跟五个水分子结合在一起,在条件不发生改变时,这一组成保持不变,分子中的H2O,不同于普通的H2O,是结晶水合物分子的一部分,所以CuSO4·5H2O是纯净物,且属化合物,不是混合物。
化学式中的“小圆点”(“·”)是表示一种结合,求算式量时应作加法,千万不要误作数学上的“乘号”。
(CuSO4·5H2O)的式量为:64+32+16×4+5(1×2+16)=250
课后答案
第一节 分 子
第1题 (1)化学。相同;各异。
(2)1.67×1023
第2题 (1)塞紧瓶塞可以防止酒精,汽油蒸气的分子因不断运动而扩散到空气中去,造成酒精、汽油的挥发而损失。
(2)气体分子之间有相对较大的间隔,气体受压时,迫使气体分子间距离缩小,因此其体积也相应缩小。
(3)太阳照射的地方,温度较高,湿衣服上附着的水分子能量增大,运动加剧(即增加了动能),更快地扩散到空气中去,所以容易干。
第3题 (1)、(2)不正确;(3)正确。
第4题 属于混合物的是:(2)、(7);属于纯净物的是:(1)、(3)、(4)、(5)、(6)。
第二节 原子
第1题 (1)B (2)B (3)B
第2题 构成原子的微粒有质子、中子和电子。在氧原子中由8个质子和8个中子构成原子核,有8个电子在核外一定空间内高速运动。质子带一个单位正电荷,中子不显电性,电子带一个单位负电荷。原子中核电荷数=质子数=核外电子数。由于整个原子中正负电荷数相等,所以不显电性。
第3题 (1)有错。原子量不是原子的实际质量。
原子量是国际上通用的,它以一种碳12原子质量的1/12作为标准,其它原子的质量跟它比较所得的数值。
(2)错。应改为:原子量的单位是一。
(3)对。
(4)对。
第4题 (1)水受热时其分子动能增大,分子间距离增大,由液态变成气态。
(2)氧化汞分子受热分解为汞原子和氧原子,每两个氧原子结合成氧气分子,汞原子则聚集成汞。
(3)蔗糖分子分散于水分子之间。
(4)樟脑分子从固体聚集状态升华为气态。
达标训练
5、分子与原子的不同
|
分 子 |
原 子 |
|
(1)分子是保持物质化学性质的最小粒子 |
(1)原子是化学变化中的最小粒子 |
|
(2)在化学变化中分子的种类一定改变,数目可能改变 |
(2)在化学变化中原子的种类,数目,质量均不改变 |
|
(3)由分子构成的物质中化学性质由分子保持 |
(3)由分子构成的物质中原子不保持物质的化学性质。由原子直接构成的物质中,原子才保持物质的化学性质 |
|
(4)用化学式表示 |
(4)用元素符号表示 |
|
(5)分子由同种或不同种的原子构成 |
(5)由质子、中子、核外电子构成 |
|
(6)可以独立存在 |
(6)多数情况下相互结合存在于分子中 |
分子与原子的联系: |
注意:分子与构成这种分子的原子相比较,原子比分子小,但并不是所有的原子都一定比分子小。如最小的氢分子中,一个分子共含有2个质子和2个电子,其体积和质量均没有氧原子大。一个氧原子中就含有8个质子,8个中子和8个电子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com