
题目列表(包括答案和解析)
9.下列实验设计能完成或实验结论合理的是
A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可向瓶中加入适量的水,观察所得溶液的颜色
B.某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明该溶液中有Ca2+
C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D.用核磁共振氢谱图鉴别乙醇和乙酸
8.下列溶液中可能大量共存的离子组是
A.无色澄清透明溶液中:K+、H+、Cl-、MnO4-
B.在pH=1的溶液中:NH4+、K+、ClO-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.由水电离出c(H+)=10-12 mol·L-1的溶液:K+、Al3+、Cl-、SO42-
不定项选择题:本题包括6小题,每小题4分,共计24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
7.下列排列顺序正确的是
A.稳定性:NH3<PH3<AsH3 B.酸性: H2SO4>H3PO4>H2SiO3
C.还原性: S2- < Br- < Fe2+ D.熔沸点:丙烷<正丁烷<异丁烷
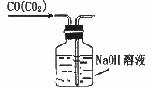
6.
 下列实验能达到目的的是
下列实验能达到目的的是

|
|
|
|
5. 铅蓄电池用途很广,电解液为30%的硫酸溶液,电池的总反应式可表示为:
铅蓄电池用途很广,电解液为30%的硫酸溶液,电池的总反应式可表示为:
Pb(s)+ PbO2(s)+ H2SO4(aq) 2PbSO4(s) + 2H2O(l)
有关该电池的说法不正确的是
A.放电时负极反应:Pb(s)+SO42-(aq)-2e-=PbSO4(s)
B.充电时阳极反应:PbSO4(s) + 2H2O(l) -2e- = PbO2(s) + 4 H+(aq)+SO42-(aq)
C.放电时,电解液的密度不断增大
D.充电时,电解液的pH不断减小
4.下列有关化工生产的叙述中正确的是
A.将煤液化、气化,有利于提高燃料的燃烧效率
B.侯氏制碱法,向饱和NaCl溶液中先通入CO2再通入氨气制取纯碱
C.电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等
D.工业生产硫酸中,建立高烟囱可以降低地面SO2的浓度,减少空气污染
3.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1 mol Cl2发生反应时,转移的电子数一定是2 NA
B.标准状况下,2.24 L己烷中含有的非极性键数为0.5 NA
C.1 L 1 mol·L一1的 FeCl3溶液中含有铁离子的数目为 NA
D.常温常压下,4.4 g CO2和N2O混合物中所含有的原子数为0.3NA
2. 下列有关化学用语或名称表达正确的是
下列有关化学用语或名称表达正确的是
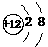 A.Mg的原子结构示意图: B.乙酸分子的比例模型:
A.Mg的原子结构示意图: B.乙酸分子的比例模型:
|
|
 C.H2O2的电子式:H+ [ O
O ]2- H+ D.
的名称:2-乙基丙烷
C.H2O2的电子式:H+ [ O
O ]2- H+ D.
的名称:2-乙基丙烷
1.化学与生活、社会密切相关。下列说法正确的是
A.臭氧能对水体消毒,是因为其能杀死水中的病菌
B.执行“限塑令”主要是为了节约资源
C.含磷洗涤剂不会导致水体污染,是因为其易被细菌分解
D.新装修的住房中放置任何花卉都能降低居室中甲醛含量
22.(8分)下图各物质是中学化学中常见的物质,甲、乙、丙、丁均是离子化合物,其中甲、乙物质中分别含有四种元素,且阴阳离子个数比为1:1。B、D常温下是气体,反应①是工业生产中很重要的反应,戊是一种弱碱。E是一种弱酸,且是白色胶状沉淀。A是由两种非金属元素组成,且前后原子个数比为1:2。请回答下列问题
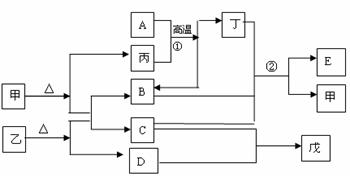
(1) A的化学式是
(2) 写出戊的电离方程式
(3) 反应①、②中有一个反应能说明A、B的水化物的酸性强弱关系,请写出该反应的方程式(若是离子反应则写离子方程式) ________________
(4) 相同条件下,等物质的量浓度的甲、乙、丙溶液中所含二价阴离子物质的量浓度从大到小依次是 _________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com