
题目列表(包括答案和解析)
19.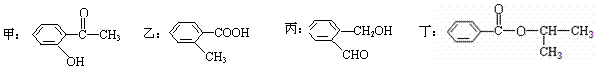 (12分)根据下列有机化合物,回答问题。
(12分)根据下列有机化合物,回答问题。
(1)上述互为同分异构体的化合物为 ;
(2)写出丙中官能团的名称 ;
(3)丁在一定条件下,可以发生水解反应,生成X、Y两种物质(相对分子质量:X<Y)。
写出丁水解的化学方程式 ;
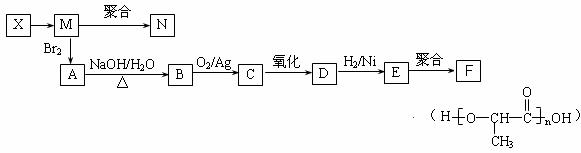 (4)由X经下列反应可制得N、F两种高分子化合物,它们都是常用的塑料。
(4)由X经下列反应可制得N、F两种高分子化合物,它们都是常用的塑料。
①X转化为M的反应类型是
②写出B转化为C的化学方程式 ;
③ 在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式为 。
18.(10分)下表是某食用碘盐包装袋上的部分说明:
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量 |
35±15mg/kg |
|
储藏方法 |
密封、避光、防潮 |
|
食用方法 |
烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
A.高温会导致碘的损失 B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾 D.该碘盐中碘酸钾含量为20~50mg/kg
|
(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并标出电子转移的方向和数目。
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
该反应的氧化剂为
(4)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解 b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全 c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示) mg/kg。
17.(10分)在一容积为2 L的密闭容器内加入2 mol的CO和6 mol的H2,在一定条件下发生如下反应:
CO(g)+ 2H2(g) CH3OH(g);ΔH < 0
CH3OH(g);ΔH < 0
(1)反应达到平衡时, CH3OH的物质的量浓度可能为______。(填字母,下同)
A.0.8 mol/L B.1.0 mol/L C.1.5 mol/L
(2)该反应在一定条件下达到平衡后,在保证H2浓度不变的情况下,增大容器的体积,试根据平衡常数,判断平衡____ _。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)该反应的逆反应速率与时间的关系如下图所示:
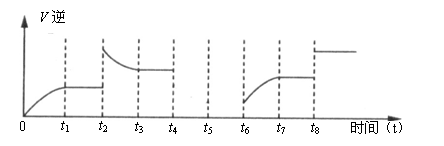
①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是 ;
②t2时的平衡常数K与t1时的相比可能 。
A.增大 B.减小 C.不变
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在上图中画出t4-t6时逆反应速率与时间的关系曲线。
16.(8分)以下框图中A→M是中学化学中常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。
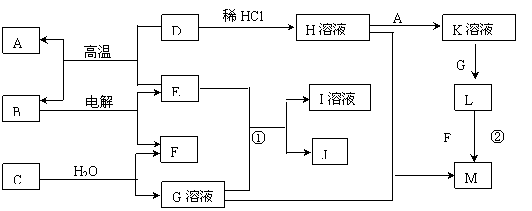
请回答下列问题:
(1)写出B的化学式 ;指出C物质中所包含的化学键类型
(2)若将H溶液加热蒸干、灼烧,最终得到的固体物质的化学式:
(3)写出①反应的离子方程式:
(4)写出②反应的化学方程式:
15.(10分)化学是一门以实验为基础的自然科学,化学实验在化学学习
中具有重要的作用。
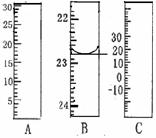
(1) 右图分别是温度计、量筒、滴定管的一部分,其中
A仪器的名称为 , B的正确读数为 。
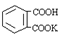 (2)实验室很难配制准确浓度的NaOH溶液,需要用基准物质来标定,邻苯二甲酸氢钾( ,,相对分子质量为204.0)是常用的基准物质。某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度。在本实验中达到滴定终点时,溶液的pH约为9.1。
(2)实验室很难配制准确浓度的NaOH溶液,需要用基准物质来标定,邻苯二甲酸氢钾( ,,相对分子质量为204.0)是常用的基准物质。某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度。在本实验中达到滴定终点时,溶液的pH约为9.1。
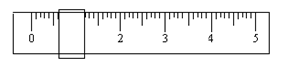 ①该学生用托盘天平称量时,先在两边托盘上放等质量的纸片,取少量邻苯二甲酸氢钾置于左盘,只用游码(单位:g)调整平衡时如下图所示。由此可知,所取邻苯二甲酸氢钾的质量为 g。
①该学生用托盘天平称量时,先在两边托盘上放等质量的纸片,取少量邻苯二甲酸氢钾置于左盘,只用游码(单位:g)调整平衡时如下图所示。由此可知,所取邻苯二甲酸氢钾的质量为 g。
②将称好的邻苯二甲酸氢钾置于锥形瓶中,加适量蒸馏水完全溶解得到无色溶液,再加入1~2滴
指示剂,当观察到 现象时,可停止滴定,记录数据。
|
实验编号 |
NaOH溶液的体积(mL) |
|
1 |
22.52 |
|
2 |
22.49 |
|
3 |
22.50 |
③该学生进行了三次实验,所取固体质量均相同,达到滴定终点时记录所用未知氢氧化钠溶液的体积如下表:
则计算氢氧化钠溶液物质的量浓度的表达式为: (用数据表示,不需计算)
④以下操作会造成NaOH溶液浓度偏高的是 (填序号)
A.未用氢氧化钠溶液洗涤碱式滴定管
B.滴定前平视,滴定后俯视读数
C.滴定前滴定管尖嘴有气泡,滴定后气泡消失
D.滴定前未用邻苯二甲酸氢钾溶液洗锥形瓶
14.T ℃时,N2与H2反应生成NH3,其能量变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1 ℃和T2 ℃时,H2的体积分数与时间的关系如图(Ⅱ)所示。则下列结论正确的是
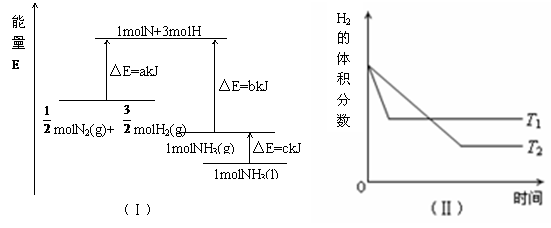
A.该反应的热化学方程式: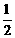 N2(g)+
N2(g)+ 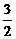 H2(g)=NH3(g);△H = (a+b)kJ·mol-1
H2(g)=NH3(g);△H = (a+b)kJ·mol-1
B.该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1);△H = 2(a-b-c)kJ·mol-1
C. T1>T2,且正反应为放热反应
 D. 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大
D. 其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大
非 选 择 题
13.下列比较中,正确的是
A.相同条件下,HF比HCN易电离,则NaF溶液的pH比NaCN溶液的大
B.0.2 mol•L-l NH4Cl 和 0.l mol•L-l NaOH 溶液等体积混合后:
c(NH4+) > c (Cl∷) > c (Na+) > c (OH-) >c (H+)
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:
c (Na+) + c(H+) = c (CH3COO-) + c (OH-)
D.同浓度的下列溶液中,①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4
c(NH4+) 由大到小的顺序是:①>②>④>③
12.某天然有机化合物,其结构如右图所示,关于该化合物的说法正确的是
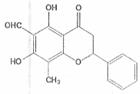 A.该化合物可以发生消去反应
A.该化合物可以发生消去反应
B.该化合物的分子式是C17H13O5
C.一定条件下,1mol该化合物最多可以和7molH2发生加成反应
D.一定条件下,该化合物可以发生银镜反应
11.下列离子方程式正确的是
A.向氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2- +4NH4+ + 2H2O
B.苯酚钠溶液中通入少量CO2:CO2 + H2O+ 2C6H5O- → 2C6H5OH + 2CO32-
C.碳酸氢铵溶液中加入足量NaOH溶液:NH4++ HCO3-+2OH- = CO32-+NH3·H2O+H2O
D.Fe(NO3)3 溶液中加入过量 HI 溶液: 2Fe3+ + 2I-=2Fe2+ + I2
10.下列说法正确的是
A.自发反应一定是熵变大于0的反应
B.利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液
C.提取溴水中的溴,可通过加入裂化汽油进行萃取
D.用Na2CO3溶液可使水垢中的CaSO4转化为CaCO3,是因为Ksp(CaSO4)<Ksp(CaCO3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com