
题目列表(包括答案和解析)
17、(11分)人类对氢气的研究更趋深入,“氢能”将是未来最理想的新能源。
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为___________ ________________。
(2)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。(提示:反应②的产物是O2、SO2和H2O)

完成下列反应的化学方程式:反应①______________;反应②_____________________。此法制取氢气的最大优点是_____________________________。
(3)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g)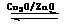 CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示:
CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示:
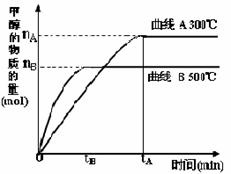
①合成甲醇反应,其反应热△H______0。(填“>”、“<”或“=”)
②据研究,合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)_______________________________________。
15 (15分)下表列出前20号元素中的某些元素性质的一些数据:
|
元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
原子半径(10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
|
最高价态 |
+6 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
|
最低价态 |
-2 |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是: (填编号)。
(2) 写出下列有关反应的化学方程式:
① E的单质与I元素的最高价氧化物对应的水化物反应:
;
②H2C2与EC2反应:
。
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是 (写分子式)。元素I、J形成的化合物可能是什么晶体 。比元素B原子序数大5的元素基态原子电子排布式是 。
(4)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中E元素原子以 和 杂化成键,分子中共形成 个σ键, 个π键。
(5)C和I相比较,非金属性较弱的是 (填元素名称),可以验证你的结论的是下列中的 (填编号)。
a.气态氢化物的稳定性和挥发性 b. 单质分子中的键能
c. 两元素的电负性 d .含氧酸的酸性
e .氢化物中X-H键的键长(X代表C和I两元素) f.两单质在自然界的存在
16.(10分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数
A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
14.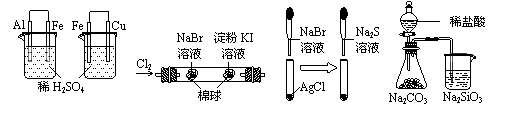 根据下列实验现象,所得结论正确的是
根据下列实验现象,所得结论正确的是
A B C D
|
实验 |
实验现象 |
结论 |
|
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C |
白色固体先变为淡黄色,后变为黑色 |
溶解性AgCl>AgBr>Ag2S |
|
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
化学答案纸
请将选择题的答案填入下表
13.某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①pH试纸检验,溶液的pH>7。②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液。④向分液后的水溶液中加入Ba(NO3)2和HNO3溶液,有白色沉淀产生,过滤。⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。则关于原溶液的判断中不正确的是
A.肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-
B.肯定存在的离子是Na+、K+、SO32-、Br- 、Cl-
C.无法确定原溶液中是否存在Cl-
D.若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响。
12.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
11.把一瓶不饱和的烧碱溶液分成4等份。保持温度不变,向4份溶液中分别加入一定量的NaOH固体、Na2O2、Na2O和Na,使溶液均恰好饱和,下列说法中正确的是
A.加入的NaOH质量一定最大
B.加入的Na2O2和Na2O的物质的量之比为1︰1
C.制成饱和溶液后,4份溶液中所含NaOH质量相同
D.加入的NaOH、Na2O2、Na2O、Na的物质的量之比为2∶1∶1∶2
10.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强
均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A.甲的相对分子质量比乙的相对分子质量小 B. 甲的摩尔体积比乙的摩尔体积小C.甲的分子数比乙的分子数少 D.甲中所含的原子数比乙中的所含的原子数少
9.两种微粒的质子数和电子数都相等,它们不可能是
A.一种阳离子和一种阴离子 B.一种原子和一种分子
C. 一种单质分子和一种化合物分子 D. 一种分子和一种离子
8.下列离子方程式正确的是
A.向碳酸氢钙(aq)中加入少量氢氧化钾(aq):
Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.氯化铵与氢氧化钠两种浓溶液混合加热OH- + NH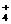 △ H2O + NH3↑
△ H2O + NH3↑
C.少量金属钠投入水中:Na+2H2O=Na++2OH-+H2↑
D.单质铜与稀硝酸反应 Cu + 2 H++ 2NO = Cu2+ + 2NO↑+H2O
= Cu2+ + 2NO↑+H2O
7.25℃时,在含有大量Ba2+的某澄清透明溶液中,由水电离产生的OH-物质的量浓度为1×10-12mol/L,则在此溶液中还可能大量共存的离子组有
A.Na+、Fe2+、NO3- B.K+、CH3COO-、SO42-
C.NH4+、HCO3-、SCN- D.Cu2+、Mg2+、Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com