
题目列表(包括答案和解析)
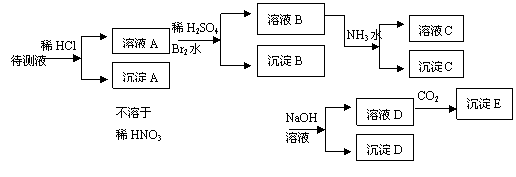
27.(15分)某待测溶液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、NH4+等离子,进行如下实验(所加酸、碱、氨水、溴水CO2都是过量的)。
|
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子理由是:
。
(2)写出溶液A中离子与Br2水反应的离子方程式:
。
(3)写出从溶液D生成沉淀E的反应的离子方程式:
。
(4)写出从溶液B生成沉淀C的反应的离子方程式:
。
26.(9分)矿泉水一般是由岩石风化后被地下水溶出其可溶部分生成的。风化作用是指矿物与水和CO2同时作用的过程。例如:以下是黑云母(一种硅酸盐)这种矿物风化成高岭石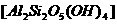 (一种硅酸盐)的反应为:
(一种硅酸盐)的反应为:
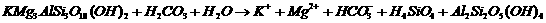 (未配平),回答下列问题:
(未配平),回答下列问题:
(1)把上述反应方程式配平的系数依次为
(2)上述反应发生的理由是 。
(3)地球化学中,通常用热重分析法研究矿物在受热时质量变化以确定其组成。加热黑云母到673K-1123K区间内分解为相应的氧化物,试计算黑云母失重的百分比为
(计算结果保留三位有效数字)
24、(6分)有一瓶澄清透明溶液,可能含有NH4+、Fe2+、Fe3+、Ba2+、Al3+、SO42-、
HCO3-、NO3-、C1-中的一种或几种。取该溶液进行以下实验:
(1) 溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2) 取部分溶液浓缩后加入铜片和浓硫酸共热,有红棕色气体生成;
(3) 取少量溶液,加入硝酸酸化的氯化钡溶液,产生白色沉淀;
(4) 将(3)中的沉淀滤出,滤液中加入硝酸银溶液,生成白色沉淀;
(5) 另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程先看到生成沉淀,随之沉淀部分溶解,并呈红褐色。
根据上述实验事实确定:在该溶液中肯定存在的离子是 ,肯定不存在的离子是 ,不能确定是否存在的离子是 。
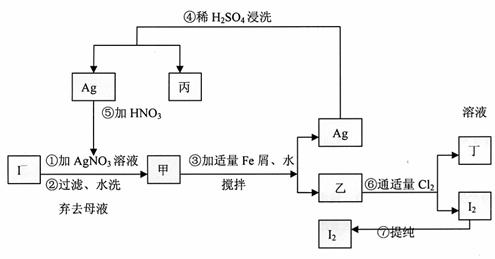 25.(13分)在已知提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
25.(13分)在已知提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
试回答:
(1)书写化学式:沉淀甲 ,丙中的溶质 。
(2)第④步操作中用稀H2SO4浸洗的目的是 (填写字母编号)
a.除去未反应的NO3- b.除去未反应的I-
c.除去未反应的Fe d.除去碱性物质
(3)第⑦步操作可供提纯的方法有多种,其中不合适的是 (填写字母编号)
A升华 B凝华 C萃取 D分液 E减压蒸馏 F渗析 G重结晶
(4)第⑥步操中反应的离子方程式 。
(5)第⑤步操中用稀硝酸溶解银,试写出反应的化学方程式并标明电子转移的方向和总数 。
23.(12分)实验室用固体烧碱配制500mL 0.1mol·L-1的NaOH溶液。
①需称量______ ____ g的烧碱固体,固体应放在____________中称量。
②配制过程中,一定不需要使用的仪器是(填符号)_____________。
A烧杯 B量筒 C玻璃棒 D1000mL容量瓶 E漏斗
③根据实验的实际需要和②中列出的仪器判断,完成实验还缺少的仪器是____________ (填仪器名称)。
④ⅰ如果没有用蒸馏水洗涤烧杯、玻璃棒,配成的溶液的物质的量浓度比要求的____ (填“偏高”或“偏低” );ⅱ有位同学在定容时不小心多加了水使液面高于刻度线,于是他用胶头滴管吸出过多的上层溶液。这样将会使配得的溶液的物质的量浓度 (填“偏高”、“偏低”或“无影响” )。
22、(6分)已知: NO3-+4H++3e→NO+2H2O 。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中有一种(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:___________________________________。
(2)反应中硝酸体现了________________ 、________________ 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________________ mol。
21.(10分)(1)把淀粉溶于碘化钾溶液中,制成淀粉-KI试液,回答下列问题。
①鉴别水溶液和胶体可以利用的方法是 。
②把淀粉-KI试液装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里。从半透膜里析出的分散质是 ,该操作的名称是 。
(2)把少量的饱和氯化铁溶液滴入沸水中,制成Fe(OH)3胶体,回答下列问题。
③试写出上述反应的化学方程式 。
④向Fe(OH)3胶体中滴入硫酸直到过量,试描述此过程的实验现象
。
20、今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A K+一定存在 B 100mL溶液中含0.01mol CO32-
C Cl-一定存在 D Ba2+一定不存在,Mg2+可能存在
第Ⅱ卷(非选择题,共80分)
19.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备--2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备--2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是
A.高铁酸钾与水反应时,水发生还原反应
B.湿法中每生成1mol Na2FeO4共转移3mol电子
C.干法中每生成1mol Na2FeO4共转移5mol电子
D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降
18.下列离子方程式正确的是
A.氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
B.向Ba(OH)2溶液中逐滴NaHSO4溶液至溶液刚好呈中性
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.用氯化铁溶液腐蚀印刷线路铜板:Fe3++Cu=Fe2++Cu2+
D.向碳酸氢钠溶液中滴入少量石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O
17.阿伏加德罗常数的值约为6.02×1023。下列叙述中正确的是
A.室温下,22.4L乙烷和乙烯的混合气体中含有的C原子数约为6.02×1023
B.标准状况下,11.2LCCl4含有的分子数约为0.5×6.02×1023
C.常温常压下,17g1H216O2中含有的中子数约为8×6.02×1023
D.0.5L0.5mol/L的NaNO3溶液中含有的粒子总数约为0.5×6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com