
题目列表(包括答案和解析)
19.⑴在常温下,向饱和Na2CO3的溶液中通入足量的CO2会有晶体析出,此晶体是 。析出该晶体的原因是 。
写出该反应的离子方程式:
⑵在饱和的食盐水中先通入足量的氨,再通入足量的CO2,会有NaHCO3晶体析出,若在饱和的食盐水中先通入足量的CO2,再通入氨气,往往没有晶体析出,原因是 。
18.将a molNaHCO3和b mol Na2O2混合置于密闭容器中加热到300℃使其充分反应:
(1)反应后的气体只有O2,则a和b的关系 。
(2)反应后的固体只有Na2CO3,则a和b的关系 。
(3)反应后的固体为Na2CO3和NaOH的混合物,则a和b的关系 。
(4)若反应后气体为O2和H2O(g)的混合气体,则
n (O2)= n (H2O)=
17.有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
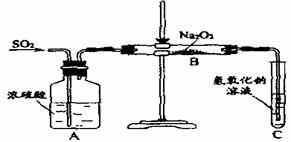
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:







上述方案是否合理? 。
请简要说明两点理由:
① ;② 。
16.有Ba(OH)2、NaHSO4、NaHCO3三种溶液,已知其中两种溶液的物质的量浓度相同,且分别为另一种溶液的物质的量浓度的2倍;若先将NaHSO4和NaHCO3溶液各 100 mL混合反应后,再加入Ba(OH)2溶液100mL,充分反应后,将生成的白色沉淀滤出,测得滤液中只含一种NaOH溶质,其物质的量的浓度为0.9mol/L(不考虑溶液混和时引起溶液体积的变化),试回答:
(1)通过分析,判断原Ba(OH)2、NaHSO4、NaHCO3三种溶液中哪两种溶液的物质的量的浓度不可能相同? ,原因是 。
(2)Ba(OH)2、NaHSO4、NaHCO3三种溶液可能的物质的量的浓度分别为__________、
____ _____、_________。
15.⑴某小组在做实验时,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此现象分别做了如下推测:
甲:反应后试管很热,可能溶液温度较高使红色褪去。
乙:因为所加水的量较少,红色褪去可能是生成的NaOH溶液浓度较大的影响。
丙:Na2O2具有强氧化性,生成物中O2、H2O2(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质。
验证甲同学的推测是否正确的方法是 ,
验证乙同学的推测是否正确的方法是 ;
当出现 现象时,即可说明丙同学的推测正确。
⑵向0.1mol/L的Na2CO3溶液中滴加酚酞,溶液变为红色的原因(用离子方程式表示)
,加热后颜色变深的原因是
;向1mol/L的NaHCO3溶液中滴加酚酞,溶液变为红色,加热颜色加深的可能原因(写出两种可能的原因):
① ;
②
14.向含有下列离子的溶液中加入一小块过氧化钠,引起离子数目减少的是( )
A. CO32- B. OH- C. NH4+ D. SO32-
第Ⅱ卷(共72分)
13.在一密闭容器中有CO、H2、O2共16.5g和足量的Na2O2,用电火花引燃,使起充完全反应,固体增加了7.5g,则原混合气体中O2的质量分数为( )
A.36% B.54.5% C.40% D.33.3%
12.碱金属(如锂、钠、钾、铷等)溶于汞中可形成良好的还原剂“汞齐”。取7g某种碱金属的汞齐与水作用得到0.2g氢气,并得到密度为ρ g/cm3的溶液1L,则溶液中溶质的质量分数可以是 ( )
A.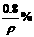 B.
B. 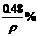 C.
C.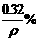 D.
D.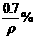
11.所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
|
|
Na |
Cu |
Al |
Fe |
|
熔点(0C) |
97.5 |
1083 |
660 |
1535 |
|
沸点(0C) |
883 |
2595 |
2200 |
3000 |
其中不能形成合金的是 ( )
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
10. 下列反应,最终有沉淀生成的是 ( )
A.向石灰水中通入过量的CO2
B.向苯酚钠溶液中通入过量的CO2
C.向氯化钙溶液中通入过量的CO2
D.向硅酸钠溶液中通入过量的CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com