
题目列表(包括答案和解析)
4.有关天然物质水解叙述不正确的是
A.蛋白质水解的最终产物均为氨基酸
B.可用碘水检验淀粉是否水解完全
C.变质的油脂有难闻的气味,是由于油脂发生了水解反应
D.纤维素水解和淀粉水解得到的最终产物相同
3.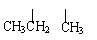 对于烃CH3-CH2-CH2-CH-CH-CH3的命名正确的是
对于烃CH3-CH2-CH2-CH-CH-CH3的命名正确的是
A.2-甲基-3-丙基戊烷 B.3-异丙基己烷
C.2-甲基-3-乙基己烷 D.5-甲基-4-乙基己烷
2.有一只50mL酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处,把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积
A.大于40.0 mL B.为40.0 mL C.大于10.0 mL D.为10.0mL
1.下列各项中表达不正确的是
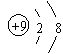


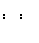
A.F-的结构示意图: B.NaCl的电子式:Na Cl
C.CO2分子的结构式:O=C=O D.碳-12原子:12 6C
21.工业上电解质量分数为23.4%的精制食盐水a kg,电解后残液的密度为ρ kg/L。将产生的H2、Cl2在一定条件下反应制成质量分数为36.5%的盐酸b kg,已知H2、C12的利用率均为c%。试计算(用含题中字母的代数式表示):
(1)制得氯化氢__________mol。
(2)残液中氯化钠的质量_________________ Kg。
(3)残液中氢氧化钠的物质的量浓度 mol/L。
⑶ 请设计实验方案进一步确定该固体混合物的组成。叙述实验操作、预期现象和结论。
|
实验操作 |
预期现象和结论 |
|
|
|
|
|
|
20.(12分)课题式课堂教学是研究性学习的一种方式,其基本教学模式为:

如图是关于‘‘一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的证明CO具有还原性的实验装置。
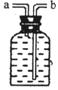
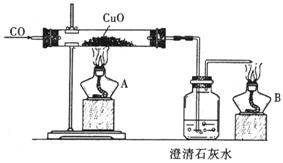
(1)实验时应先点燃 处(填“A”或“B”)的酒精灯。
(2)硬质试管中反应的化学方程式为 。
(3)乙同学认为甲装置有待优化,如尾气可先储存在瓶内,然后再处理。如右上图是他
设计的贮气瓶,尾气应从 (选填“a”或“b”)口通入(其它装置略)。
(4)丙同学质疑:CO能否使澄清石灰水变浑浊? 因此,他设计在CO通入CuO之前,
应先通入澄清石灰水,以比较排除CO与澄清石灰水反应,试对此作出评价。你认为
丙的设计是否有必要: ,理由是 。
(5)如果开始时通入的是CO和CO2的混合气体,则应如何设计才能达到实验目的?
。
取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味。用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
⑴ 用 (填实验用品名称)取固体混合物于烧杯中。
⑵ 上述实验可以得到的初步结论是 。
19.(10分)已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种,且物质的量之比为1:1。请完成下述探究混合物组成的实验。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、淀粉碘化钾试纸;1mol/L硫酸、1mol/L硝酸、1mol/L盐酸、1mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
18.下图所示各物质是由1-20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出。已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
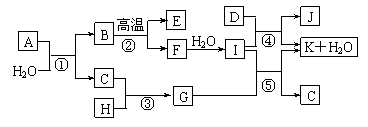
请回答下列问题:
⑴物质E的电子式是____________;物质J的名称为 。
⑵反应⑤的化学方程式为___________________________________________。
⑶反应③的现象为___________________________________________。
⑷物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为________。
17.(14分)将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
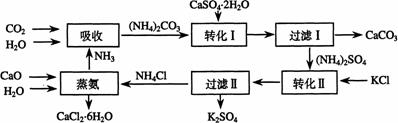
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要 等原料。
(2)石膏悬浊液中加入碳酸铵溶液后反应的离子方程式为 。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:
。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是因为 (选填序号)
a. 熔点较低(29℃熔化) b. 能导电 c. 能制冷 d. 无毒
(6)简述如何用实验的方法证明硫酸钾肥料中钾元素的存在?
。
(7)上述工艺流程中体现绿色化学理念的是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com