
题目列表(包括答案和解析)
7.在烧杯甲中放入20g Na2O2,在烧杯乙中放入20g氢氧化钡与氯化铵的混合物,分别加入20mL水,搅拌,使它们溶解,然后把盛有少量乙醚液体的试管浸入烧杯甲的溶液中,用明火接近试管口,能产生黄色火焰,再把此试管浸入烧杯乙的溶液中,发现黄色火焰由长变短,直至熄灭。上述两实验可说明的是
①乙醚可燃 ②乙醚的沸点较低
③氢氧化钡与氯化铵混合能吸收大量热 ④Na2O2溶于水能放出大量的热
A.①②③ B.①③④ C.②③④ D.①②③④
5.下列离子方程式正确的是
A.在硫酸铜溶液中加入过量氢氧化钡溶液:Ba2++SO42-=BaSO4↓
B.碳酸氢钠溶液与少量石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
C.向氯化铝溶液中加入过量氨水:A13++4NH3·H2O A1O2-+4NH4++2H2O
A1O2-+4NH4++2H2O
D.NH4HCO3溶液与过量NaOH溶液混合后加热:NH4++OH-=NH3↑+H2O
|
① 酸性氧化物在一定条件下均能与碱发生反应② 弱酸与盐溶液反应可以生成强酸,
③ 发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成,
④ 两种酸溶液充分反应后,所得溶液呈中性,
⑤ 有单质参加的反应,但该反应不是氧化还原反应,
⑥ 两种氧化物发生反应有气体生成
A.①②③④⑤⑥ B.②④⑤⑥ C.①②③⑤ D.③④⑤⑥
4.有t℃的a g KCl不饱和溶液,其质量分数为ω1,采取措施后使其变为b g饱和溶液,其溶质质量分数为ω2,下列说法正确的是 A.a一定小于或等于b B..aω1一定等于b ω2 C.t℃时KCl溶解度一定大于100ω1 D.ω1一定大于ω2
3.下面几位同学自己总结出的结论中不正确的是
A.将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低
B.式量比空气(29)小的气体不使用向上排空气法收集
C.有些化学反应可以不属于化合、分解、置换、复分解中的任何一种反应类型
D.原子晶体的熔点不一定都比金属晶体的高,分子晶体的熔点不一定比金属晶体的低
2.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。下列关于“暖冰”的说法正确的是
A.暖冰中水分子是直线型分子
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.暖冰中水分子的各原子均满足8电子稳定结构
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
1.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类。PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述不正确的是
A.PE、PVC都属于链状高分子化合物,受热易熔化
B.PE、PVC的单体都是不饱和烃,能使溴水褪色
C.焚烧PVC保鲜膜会放出有毒气体如HCl
D.废弃的PE和PVC均可回收利用以减少白色污染
28.(7分)某硫酸厂在进行黄铁矿(主要成分是FeS2)成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:①SO2+2Fe2++2H2O=SO2- 4+2Fe3++4H+
②___ Cr2O2- 7+___ Fe2++___ H+=___ Cr3++____ Fe3++_____ H2O
⑴在反应②的横线上填写相应的化学计量数。
⑵若灼烧6g FeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,写出SO2气体转化为SO3的热化学方程式:____________________________________________________。
⑶求样品中的质量分数(假设杂质不参加反应),写出计算过程。
27.(4分)250℃时将24.8gNaOH和NaHCO3的混合物放在密闭容器中加热,充分反应后,称得剩余固体的质量为23g。请回答:
⑴NaOH和NaHCO3的物质的量之比为______1(填>、<或=)。
⑵NaOH的物质的量为_______________。
26.(13分)Ⅰ.硫酸的消费量常被作为有关国家工业发达水平的一种标志,下表为接触法制硫酸时,温度和压强对SO2转化率的影响:
|
压强/MPa 温度/℃ |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
⑴硫酸工业在国民经济中占有重要的地位,请写出它的两种重要用途:
___________________、_____________________。
⑵工业中催化氧化SO2采用常压而不用高压,理由是___________________________________
_______________________________________。
Ⅱ.实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并收集得到SO3。已知SO3熔点为16.8℃,沸点44.8℃,且SO3遇水剧烈反应。
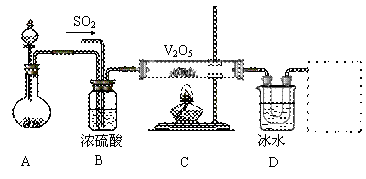
⑴写出A装置中制取氧气的化学方程式__________________________________。
⑵B装置的作用除了将气体充分混合外,还有:
①________________________________,②_________________________________。
⑶加热硬质玻璃管时,若不断升高温度,对SO2和O2生成SO3的化学反应有何影响:
_____________________________________________________________。
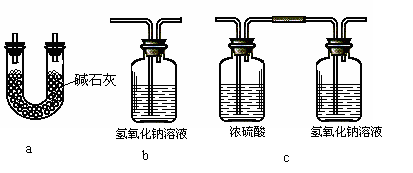
⑷本实验装置虚框处还需接一装置,甲、乙、丙三同学分别设计了a、b、c三套装置,你认为不合理的是________,理由是______________________________________。
25.(4分)下列实验基本操作或说法正确的是______(填写序号)。
①如果硝基苯或苯酚浓溶液沾到皮肤上,应立即用氢氧化钠溶液冲洗;
②25℃时测得CH3COONa溶液的pH大于7,即可证明醋酸为弱酸;
③石蕊试纸或pH试纸使用前都应用蒸馏水润湿;
④浓硝酸或氢氟酸都应保存在棕色细口玻璃试剂瓶中;
⑤在石油的分馏实验中,温度剂需插入液体中;
⑥容量瓶中含有少量蒸馏水,对配制一定物质的量浓度的硫酸溶液无影响;
⑦向沸腾的氢氧化钠溶液中滴加少量饱和氯化铁溶液以制取氢氧化铁胶体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com