
题目列表(包括答案和解析)
2.某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。上述说法正确的是( )
A.①②③④ B.①②⑤⑥ C.③⑤⑥⑦ D.①③④⑦
1.下列化学式既能表示物质的组成,又能表示物质的一个分子的是( )
A.NaOH B.SiO2 C.Fe D.C3H8
25.(12分)“凯氏定氮法”是通过测试含氮量(氮元素的质量分数)来估算奶品中蛋白质含量的一种方法。为了提高氮的检出量,不法分子将三聚氰胺添加进婴幼儿奶粉中,使许多婴幼儿长期服用后产生结石,严重影响了婴幼儿的健康。
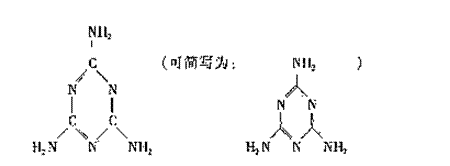 (1)三聚氰胺的结构简式如下,关于它的下列说法正确的是
(填字母)。
(1)三聚氰胺的结构简式如下,关于它的下列说法正确的是
(填字母)。
a.属于有机物
b.属于高分子化合物
c.分子式为C3H6N6
d.三聚氰胺的含氮量高于蛋白质的含氮量
(2)三聚氰胺遇强酸或强碱发生一系列水解反应,氨基逐步被羟基取代,最终得到三聚
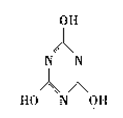
氰酸( )。三聚氰酸可看成是三分子氰酸通过加成反应得到的环
状分子,则氰酸的分子式是 。
(3)异氰酸是氰酸的同分异构体,二者同为链状结构,且分子中除氢原子外,其他原子均满足最外层的8电子结构,则异氰酸的结构式是 。
异氰酸可用于消除汽车尾气中的氮氧化物,以NO2转化为例,已知1mol异氰酸与NO2完全反应时,失去电子的物质的量为3mol,则异氰酸与NO2反应的化学方程式是 。
(4)为测定某牛奶样品中蛋白质的含量进行如下实验:①称取2.50g样品,用浓硫酸使氮转化为铵盐;②加入足量浓的强碱液充分反应将氨蒸出;③用过量硼酸吸收所得的氨[2NH3+4H2BO3=(NH4)2B4O2+5H2O];④加入指示剂并用标准的盐酸滴定[(NH4)2B4O2+2HC1+5H2O=2NH2C1+4H3BO3],消耗盐酸1.00mL;⑤另取0.214g纯的NH4C1,重复②-④的操作步骤,最终耗去标准盐酸50.00mL。
步骤②是反徉的离子方程式是 ;
此牛奶中蛋白质的质量分数是(已知奶品中的蛋白质平均含氨量16%) 。
24.(14分)已知:
(R,R′可表示烃基或官能团)
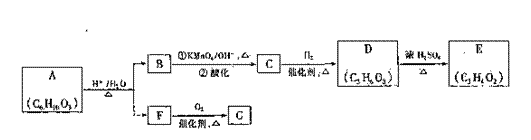 A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
请回答:
(1)F的蒸气密度是相同条件下H2密度的21倍,且分子中无甲基。已知1molF与足量金属钠作用产生H222.4L(标准状况),则F的分子式是 ,名称是 。
(2)G与F的相对分子质量之差为4,则G具有的性质是 (填字母)。
a.可与银氨溶液反应
b.可与乙酸发生酯化反应
c.可以氢气发生加成反应
d.1 mil G最多可与2mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D-E的化学方程式是
,该反应类型是 反应。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是
。
(5)A转化为B和F的化学方程式是
。
23.(7分)亚硝酰氯(NOC1)是有机合成中的重要试剂,可由NO与C12在通常条件下反应得到(NO2与C12反应可得硝酰氯)。亚硝酰氯的熔点为-64.5℃,沸点为-5.5℃,并且遇水蒸气分解成氮的氧化物和氯化氢。
某小组同学按如下流程制备亚硝酰氯(“→”表气流方向,G为尾气处理装置),实验时,先通入C12,待E中U形管内充满黄绿色气体时,再缓缓通入NO。
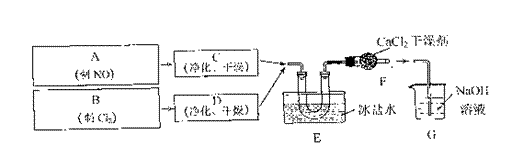
依据上述信息,请回答:
(1)实验室制备C12的化学方程式是 。
(2)装置F的作用是 。
(3)亚硝酰氯与水反应的化学方程式是 。
(4)实验中“先通入C12,待E中U形管内充满黄绿色气体时,再将NO缓缓通入”,此操作的目的是
。
22.(4分)为了证明溴乙烷中含有溴元素,下列操作的正确顺序是 (填序号)。
①滴加AgNO3溶液 ②充分振荡、静置
③取上层水溶液 ④加入5%的NaOH溶液
⑤滴加过量稀HBNO3
滴加AgNO3溶液时发生反应的离子方程式是 。
21.(11分)合成氨对工、农业生产和国防都有重要意义。
已知:N(g)+3H2(g) 2NH3(g);△H=-92.4kJ·mol-1.请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是 (填字母)。
a.用铁触煤加快化学反应速率
b.采用较高压强(20MPa-50MPa)
 c.将原料气中的少量CO等气体净化除去
c.将原料气中的少量CO等气体净化除去
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1molN2和
3molH2并发生反应。
①若容器容积恒定,达到平衡时,气体的
压强为原来的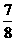 ,则N2的转化率a1= 。
,则N2的转化率a1= 。
此时,反应放热 kJ。
②若容器压强恒定,则达到平衡时,容器中N2
的转化率a2= a1(填“>”、“<”或
“=”)
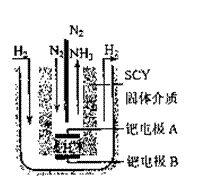
(3)随着对俣成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)的介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是 。
20.(12分)甲、乙、丙、丁、戊为五种短周期主族元素,且原子序数依次增大。甲与丁、丙与戊分别同主族,戊的原子最外层电子数比次外层少2个。甲与乙可以按照原子个数比3:1形成化合物A,且每个A分子中含有10个电子。
请回答:
(1)戊的原子结构示意图是 ,乙单质分子的电子式是 。
(2)A溶于水所得溶液呈碱性的原因是(用电离方程式表示) 。
(3)甲与丁可形成一种离子化合物,该化合物与H2O反应得到强碱溶液和H2,则该反应中,氧化剂与还原剂的物质的量之比是 。
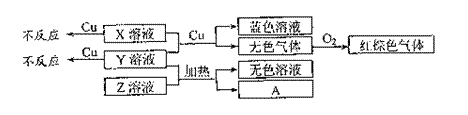 (4)X、Y、Z为三种强电解质,分别由上述五种元素中的三种组成。X、Y、Z的稀溶液之间存在如下转化关系:
(4)X、Y、Z为三种强电解质,分别由上述五种元素中的三种组成。X、Y、Z的稀溶液之间存在如下转化关系:
①用离子方程式表示Y溶液呈酸性的原因是 ;
②金属Cu与X、Y的混合溶液反应的离子方程式是:
。
19.常温下,下列各溶液中微粒的物质的量
浓度关系正确的是 ( )
A.0.1mol·L-1的Na2CO2溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B. 0.1mol·L-1的NH4C1溶液与0.05mol·L-1的NaOH溶液等体积混合后,得到的pH>7的溶液中:c(C1-)>c(Na+)>c(NH3-)>c(OH-)<c(H+)
 C.浓度分别为0.1mol·L-1和0.01mol·L-1的CH3COOH溶液中:CH3COO-离子浓度前者是后者的10倍
C.浓度分别为0.1mol·L-1和0.01mol·L-1的CH3COOH溶液中:CH3COO-离子浓度前者是后者的10倍
D.浓度均为0.1mol·L-1的 N a溶液和CH3COONa溶液中:阴离子的总
浓度前者小于后者
第Ⅱ卷(非选择题,共60分)
18.一密闭容器中发生反应:
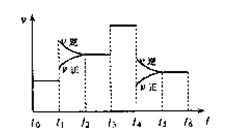 2SO2(g)+O2(g)
2SO2(g)+O2(g) 2SO3(g),
下图表示该反应的速率(v)在某一
时间(t)段内的变化。则下列时间段
中,SO3的百分含量最高的是( )
A.t0→t1 B.t2→t3
C.t3→t4 D.t5→t6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com