
题目列表(包括答案和解析)
2.北京2008奥运会金牌直径为70mm,厚6mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)。为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误( )
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
1.加强食品检测是保证食品安全、保护公众利益的重要举措,下列物质不属于食品安全检测范畴的是 ( )
A、三聚氰胺 B、苏丹红 C、亚硝酸钠 D、葡萄糖
20. (11分)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y Z+W (1)Y的电子式是_________________________。
Z+W (1)Y的电子式是_________________________。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是_________________________________。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
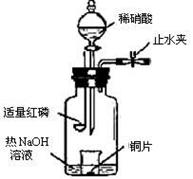
①步骤c后还缺少的一步主要操作是_______________________________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ____________。
③步骤c滴入稀硝酸后烧杯中的现象是_________________________________。
反应的离子方程式是____________________________________________________。
天水市一中2006级2008-2009学年第一学期期末考试题
19. (10分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
(10分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C
2MgO+C
④Mg+H2O MgO+H2↑ ⑤Mg3N2+6H2O
MgO+H2↑ ⑤Mg3N2+6H2O 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
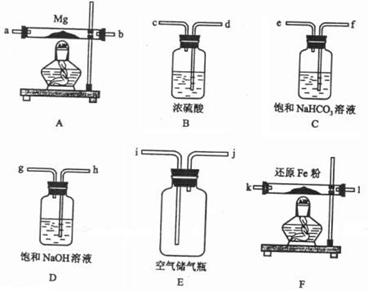
回答下列问题:
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别是 ,
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号) ;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响? ,
原因是 ;
(4)请设计一个实验,验证产物是氮化镁:
18. (10分)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)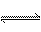 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)若上述反应在850℃进行,反应2秒时n(NO)=0.009mol,并且不再随时间而改变,则该反应是________热反应。
(2)下图中表示NO2的变化的曲线是_____________。用O2表示从0-2 s内该反应的平均速率v=_________。
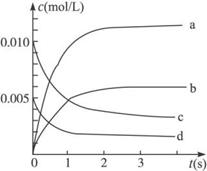
(3)能说明该反应已达到平衡状态的是______________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
17.(13分)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
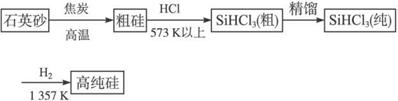
①写出由纯SiHCl3制备高纯硅的化学反应方程式____________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式_________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_________________________。
(2)下列有关硅材料的说法正确的是__________________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释_______________________________。
16. (11分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是__________;X与氢元素形成的化合物的电子式是_____________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________________;D与E能形成一种非极性分子,该分子的结构式为________________;D所在族元素的氢化物中,沸点最低的是_________________________。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是___________________________________。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为___________________ _______________________________。
15.下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的( )
A.由水电离的c(H+):①=②>③=④
B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>①>②
第Ⅱ卷(55分)
14.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是( )
|
组别 |
c(HCl)/mol·L-1 |
温度/℃ |
状态 |
|
1 |
2.0 |
25 |
块状 |
|
2 |
2.5 |
30 |
块状 |
|
3 |
2.5 |
50 |
块状 |
|
4 |
2.5 |
30 |
粉末状 |
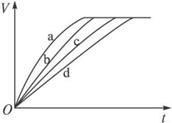
A.4-3-1-2 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
13.下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(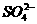 )>c(
)>c(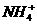 )
)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中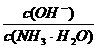 增大
增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com