
题目列表(包括答案和解析)
22.(10分)在A、B、C、D、E五种短周期元素中,A、B、C三种元素的原子序数依次增大,A、C都能与B按原子个数比为1:1或2:1形成化合物,但常温时A、B形成的化合物呈液态,C、B形成的化合物呈固态。D的原子最外层电子数最多,E的核电荷数最大,D与E能形成气态物质ED4 。
(1)画出D的原子结构简图 ________,五种元素原子半径从大到小的顺序是
(填元素符号);
(2)A与B形成的化合物中,含非极性键的化合物的结构式为 ;
(3)C与B按原子个数比为1:1形成化合物的电子式是 ,其晶体类型为 ;
(4)D、E所形成氢化物的稳定性由强到弱的顺序是 (填具体的化学式);
(5)由短周期元素组成的微粒,如,SO2、O3、NO2-,可互称为等电子体,则与B、D同周期元素组成的微粒中,能与N3-、CS2互称为等电子体的微粒是
(填符合要求所有微粒的名称);
(6)写出工业上制E单质的化学方程式 。
21.(8分)5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式:________________________。
(2)过碳酸钠是一种有多用途的新型固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子数是_________。
(4)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中氧化剂与还原剂的物质的量之比为_ 。
20.(16分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5mol/L,含FeCl2 3.0mol/L,含FeCl3 1.0mol/L,含HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:
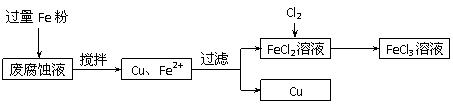

回答下列问题:
⑴ 上述方法获得的铜粉中含有杂质,除杂所需试剂是 (填化学式)。
⑵ 实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为 。
⑶ 下图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
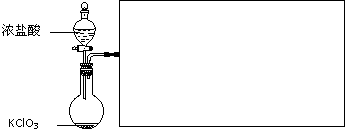

从下图挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明容器中所装试剂。


⑷ 实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是: 。
⑸ 按上述流程操作,需称取Fe粉的质量应不少于 g(精确到0.1g),需通入Cl2的物质的量不少于 mol,加入烧瓶中的KClO3的质量应不少于 g(精确到0.1g)。
19.(4分) 下列实验操作或实验叙述不正确的是 (填序号)
①配制一定物质的量浓度的溶液,为减小误差,容量瓶必须洗净并烘干后才能使用;
②用10 mL量筒量取5.80 mL盐酸;
③在中和滴定中,用待测NaOH溶液润洗锥形瓶,测定结果将偏高;
④氢氧化钠溶液保存在带胶塞的无色细口试剂瓶中
⑤金属钠着火可用干燥的细沙扑灭;
⑥中和热测定的实验中使用的玻璃仪器只有2种;
⑦检验碳酸钠溶液中是否混有氢氧化钠可先加足量的氯化钙溶液,再滴入酚酞试液;
⑧NaCl溶液、MgCl2溶液、KNO3溶液、Al2(SO4)3溶液可以用一种试剂加以区别;
⑨分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出;
⑩在中学“硫酸铜晶体中结晶水含量测定”的实验中称量操作至少需要四次。
18.在给定条件下,下列加点的物质在化学反应中能被完全消耗的是( )
A、用浓盐酸与足量二氧化锰共热制取氯气
B、标准状况下,将1g铝片投入到20mL18mo1/L的硫酸中
C、向100mL 3mo1/L的硝酸中加入5.6g铁
D、在5×107Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成氨
第Ⅱ卷(56分)
17.已知氧化还原反应: 2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
则有关该反应的说法正确的是( )
A.当1 mol Cu(IO3)2发生反应共转移的电子为10mol
B.反应中KI发生还原反应
C.CuI是还原产物,I2既是氧化产物又是还原产物
D.当1 mol Cu(IO3)2发生反应被Cu2+氧化的I-为2 mol
16.几种短周期元素的原子半径及主要化合价见下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6 -2 |
+2 |
-2 |
下列叙述正确的是( )
A.L、R的单质与稀盐酸的反应速率R>L
B.M与T形成的化合物为两性化合物
C.Q的氢化物的沸点高于T的氢化物的沸点
D.L与Q形成的简单离子核外电子数相等
15.人们研究金星大气成分,发现金星大气中有一种称之为硫化羰(COS)的分子,
其结构与CO2类似,硫化羰是一种与生命密切相关的物质,下列有关COS的推测肯定不正确的是( )
A. COS分子是含有极性键的极性分子 B. COS属于离子化合物
C. COS的结构式为S=C=O D. COS分子中所有原子都满足8电子稳定结构
14.短周期元素A、B、C的原子序数依次递增,其原子的最外层电子数之和为10.A与C在周期表中位置上下相邻,B原子最外层电子数等于A原子次外层电子数,下列有关叙述不正确的是( )
A.A与C可形成共价化合物 B.A的氢化物的稳定性大于C的氢化物的稳定性
C.原子半径A<B<C D.B的氧化物的熔点比A的氧化物熔点高
13.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.0.2 mol过氧化氢完全分解转移的电子数目为0.4 NA
B.100g 98%的浓硫酸中含氧原子个数为4NA
C.标准状况下,11.2 L SO3所含的原子数目为2NA
D.1mol甲基正离子(CH3+)所含电子数为8NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com