
题目列表(包括答案和解析)
20. (10分)500℃、20MPa时,将H2和N2置于一容积为2I。的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,根据题意完成下列各题:
(1) 500℃、20MPa时,反应处于平衡状态的时间 ;
。
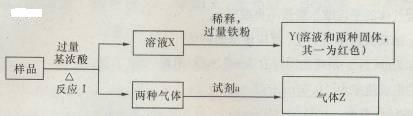
(2)反应开始到第一次平衡时,N2的平均反应速率为
。
(3)据图判断,反应进行到lOmin至20min时曲线发生变化的原因是: ;反应进行至25min时,曲线发生变化的原因是: 。
19.(12分)可能由Fe203、Fe、CuO、C、AI中的几种物质组成的混合粉末,取样进行下列实验(部分产物略去):
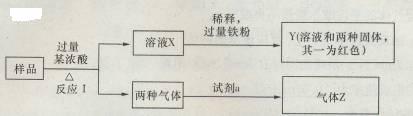
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通人C02,无明显变化,说明样品中不含有的物质是(填化学式) 。
(2)Z为一种或两种气体:
①若z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是 。
②若z为两种气体的混合物,试剂a为适量的水,则Z中两种气体的化学式是 。
(3)向Y中通入过量的Cl2,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)
。
(4)取Y中的溶液,调节pH约为7,加入淀粉KI和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2molIˉ1时,共转移3mol电子,该反应的离子方程式是
。
(5)另取原样品,加入足量稀硫酸充分反应,若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中物质用化学式表示) 。
18.(12分)某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
①需配制0.1mol·Lˉ1,的盐酸和0.1mol·Lˉ1的氢氧化钠溶液;
②取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚25.00mL0.1mol·Lˉ1的盐酸溶液。
(1)写出实验过程的步骤(写编号顺序)
(2)下图所示的仪器中配制0.1mol·Lˉ1盐酸溶液和0.1mol·Lˉ1氢氧化钠溶液肯定不需要的仪器是(填序号) 配制上述溶液还需要的玻璃仪器是(填仪器名称) 。

(3)配置上述溶液应选用的容量瓶的规格是(填字母) 。
A. 50mL、50mL B. 100mL、100mL
C. 100mL、150mL D. 250mL、250mL
(4)写出有关的化学方程式 。
(5)胃药中含碳酸钙的质量是 。
[解析](3)要滴定2次以上,所以样品溶液的总体积应超过75mL,应选B。
17.(6分)25℃时,水的离子积为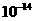 ;100℃时,水的离子积为
;100℃时,水的离子积为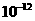 。若在100℃,将pH=11的 NaOH溶液aL与pH=l的H2SO42溶液bL混合,请填空:
。若在100℃,将pH=11的 NaOH溶液aL与pH=l的H2SO42溶液bL混合,请填空:
(1) 100℃比25℃时水的离子积较大的原因是
。
(2)若所得溶液为中性,则a:b= ;若所得混合溶液的pH=2,则a:b= 。
16.某酸性溶液中只有Na+、CH3COOˉ、H+、OHˉ四种离子。则下列描述正确的是
A.该溶液可能由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C. 加入适量的NaOH,溶液中离子浓度关系一定为c(CH3COOˉ)> c(Na+)> c(0Hˉ)> c(H+)
D. 加入适量氨水,c(CH3COOˉ)一定大于c(Na+)、c(NH4+)之和
第II卷非选择题(共60分)
15. 0.100 mol·Lˉ1的Na2S的溶液中,下列关系不正确的是
A.c(H2S)+c(HSˉ)+c(S2ˉ)=0.1
B.c(Na+)+c(H+)=2c(S2ˉ)+c(HSˉ)+c(OHˉ)
C. c(OHˉ)=f(H+)+f(HSˉ)+2c(H2S)
D. c(Na+)+c(H+)=c(S2ˉ)+c(HSˉ)+c(OHˉ)
14.常温下,1体积pH=2·5的盐酸与lO体积某-元强碱溶液恰好完全反应,则该碱溶液的pH等于
A. 9.0 B.9.5 C.10.5 D.11.0
13.下列性质递变规律不正确的是
A. HCl、HBr、HI的热稳定性逐渐减弱
B. C1ˉ、Brˉ、Iˉ离子半径依次增大
C. HCl、HBr、HI酸性依次减弱
D. HClO4,、HBr04、HIO4酸性依次减弱
12.醋酸溶液中存在电离平衡CH3COOH==== H++CH3COOˉ,下列叙述不正确的是
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OHˉ)+c(CH3COOˉ)
B. 0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OHˉ)减小
C. CH3COOH溶液中加少量的CH3COONa固体,平衡向左移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
11.下列说法不正确的是
A. 1mol氧气中含有12.04 × 个氧原子,在标准状况下占有体积22.4L
个氧原子,在标准状况下占有体积22.4L
B. 1mol臭氧和1.5mol氧气含有相同的氧原子数
C.等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:l
D.等物质的量的干冰和冰中所含氧原子数之比为2:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com