
题目列表(包括答案和解析)
8.关于氢键,下列说法正确的是
A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键
B.氯化钠易溶于水是因为形成了氢键
C.氨易液化与氨分子间存在氢键无关
D.H2O是一种非常稳定的化合物,这是由于氢键所致
7.据最新报道,科学家发现了如下反应: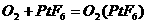 ,已知
,已知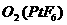 为离子化合物,其中Pt为+5价,对于此反应正确的是
为离子化合物,其中Pt为+5价,对于此反应正确的是
A.在此反应中,每生成1mol 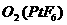 则转移1mol电子
则转移1mol电子
B.在此反应中,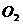 是氧化剂,
是氧化剂,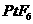 是还原剂
是还原剂
C.
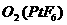 中氧元素的化合价是+1价
中氧元素的化合价是+1价
D.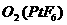 中仅存在离子键不存在共价键
中仅存在离子键不存在共价键
6. 如图,电解用粗盐(含
如图,电解用粗盐(含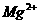 、
、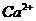 、
、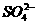 等杂质)配制的食盐水,以下说法正确的是
等杂质)配制的食盐水,以下说法正确的是
A.a是电解池的正极 B.a电极上发生还原反应
C.b电极附近有白色沉淀出现 D.b电极上有黄绿色气体产生
5.为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有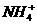 、
、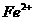 、
、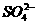 和H2O,下列实验叙述中不正确的是
和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分
中含有结晶水
B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再
滴入几滴新制
氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+
C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色
沉淀生成,则可证明晶体的成分中含有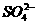
D.取少量硫酸亚铁铵晶体放入试管,加入少量稀NaOH溶液,在试管口用湿润的红色
石蕊试纸检验,则可证明晶体的成分中含有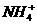
4.由短周期元素构成的某离子化合物,下列说法中正确的是
A.晶体中阳离子和阴离子个数一定相等
B.晶体中一定有离子键可能有共价键
C.所含元素一定不在同一周期也不可能在第一周期
D.晶体中阳离子半径一定大于阴离子半径
3.关于胶体和溶液的区别,下列叙述中正确的是
A.溶液呈电中性,胶体带有电荷
B.溶液中溶质微粒一定不带电,胶体中分散质微粒带有电荷
C.溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸
D.溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明亮的光带
2.下列叙述正确的是
A.复分解反应不一定不是氧化还原反应
B.只有一种生成物的化学反应不一定是化合反应
C.有阳离子存在的物质中一定存在阴离子
D.离子反应一定是复分解反应
1.下列反应不属于吸热反应的是
A.锌放入稀硫酸中 B.高锰酸钾分解
C.氢气还原氧化铜 D.碳和水蒸气在高温下反应
22.(10分)在一定温度下,把8体积SO2和4体积O2通入一个有活塞的体积可变的容器中,活塞一端与大气相通(如图所示)。容器内发生下列反应:2SO2(g)+O2(g)== 2SO3(g);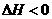
当反应达到平衡后,测得混合气体为10体积。
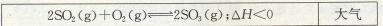
(1)保持上述温度不变,设a、b、c分别代表初始加入的SO2、O2和SO3气体的体积,如果反应过程达到平衡时,混合气体的体积仍为10体积且各物质的含量与上述平衡相同,那么:
①若a= 3,c=5,则b=6 。在此情况下反应起始时正反应速率将 (填“大
于”、“小于”或“等于”)逆反应速率。
②若欲使起始时正反应速率大于逆反应速率,则c的取值范围为 。
(2)在反应容器中,若起始时“、b.c值均与(1)相同,但须控制平衡时混合气体为9体积,则可采取的措施是 ,原理是
21.(10分)在10L密闭容器中充人lmolN2O4,在某条件下反应进行到4min时达到化学平衡,测得每1L混合气体中含NO2,3.68g。则:
(1)下列选项中不能判断混合气体达到平衡的是 (填序号);
A.混合气体的颜色不再改变
B. 混合气体的密度不再改变
C. 混合气体的压强不再改变
D.混合气体的平均摩尔质量不再改变
E. NO2的反应速率是N2O4反应速率的两倍
F.当有2mol NO2消耗的同时有lmol N2O4消耗
(2)NOz的生成速率为 ;
(3)N。O。的转化率为 ;
(4)平衡时容器内的压强是原来的 ;
(5)平衡时混合气体的平均相对分子质量为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com