
题目列表(包括答案和解析)
5.关于右图所示的原电池,下列说法正确的是
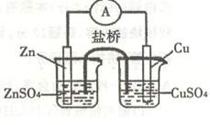 A.电子从锌电极通过检流计流向铜电极
A.电子从锌电极通过检流计流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是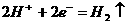
4.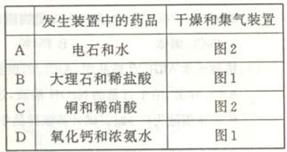
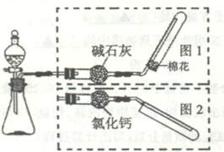 下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有二套,分别用图1和图2表示。下列选项中正确的是
下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有二套,分别用图1和图2表示。下列选项中正确的是
3.NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4LCHCl3中含有的氯原子数目为3NA
B.7gCnH2n中含有的氢原子数目为2NA
C.标准状况下,2.24L Cl2与足量的Mg充分反应,转移的电子数目为0.2NA
D.1 L0.5mol/LNa2CO3溶液中含有的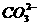 数目为0.5NA
数目为0.5NA
2.下列有关化学用语或名称不正确的是
A.CS2分子的结构式:S=C=S
B.NaHSO4在水中的电离方程式:NaHSO4=Na++H++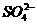
1.节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务。下列举措不符合这一要求的是
A.自2008年6月1日起,实行塑料购物袋有偿使用
B.加大石油、煤炭的开采速度,增加化石燃料的供应量
C.推广使用乙醇汽油作为汽车的燃料
D.洗涤衣物时使用无磷洗衣粉等洗涤剂
22.(12分)实验室可由软锰矿(主要成分为MnO2制备KMnO4,方法如下:软锰矿与过量固
体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,
滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得
到深紫色的针状KMnO4。
请回答:
(1)软锰矿制备K2MnO4的化学方程式是 (2分);
(2)K2MnO4制备KMnO4的离子方程式是 (2分);
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程
式是 (2分);
(5)上述制得的KMnO4产品0.165g,恰好与0.335g钝Na2C2O4反应完全,计算该
21.(14分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和Cu 2SO4在空气中加热生成CuO
提出假设
假设l:红色粉末是Fe2 O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
(1)若假设1成立,则实验现象是 (2分)。
(2)若假设2成立,则实验现象是有 (2分)。
(3)若固体放入足量稀硫酸中,经充分反应后,固体全部溶解,滴加KSCN试剂时,溶液
不变红色,则证明假设 (2分)(填数字)成立,写出可能发生的离子方程式
(6分)。
(4)经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。实验小组欲用加热法测定Cu2O
的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为 (2分)。
20.(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:

为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生
白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B (2分),D (2分)。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物
的化学式为 (2分)。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 (2分)。
(4)C常用作净水剂,用离子方程式表示其净水原理 (2分)。
19.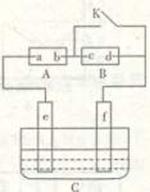 (8分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C
(8分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C
为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A的a为 极(2分);
(2)滤纸B上发生的总化学方程式为:
(2分),
(3)欲在电镀槽中实现铁上镀锌,接通K点,则电极e上发生的反应为:
(2分),槽中盛放的电镀液可以是 (2分)。
18.(12分)某工厂废气中含有SO2,可将SO2转化为(NH4)2SO4而除去。其过程为:将废气
经初步处理,使其中O2的体积分数为10%(这时SO2的体积分数为0.2%),并在400
℃时以5m3/h的速率通过V2 O5触媒层,然后与流量为25 L/h的NH3混合,再喷入
流量为290 g/h的冷水,此时气体温度迅速从400℃下降至200℃,在结晶装置中得到(NH4)2SO4晶体。回答下列问题。
(1)使废气中SO2与O2的物质的量之比为1:50,主要原因是 (2分)。
(2)反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表:
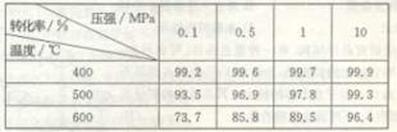
已知SO2的氧化是放热反应,利用表中数据推断工业上应选用
(2分)的条件进行生产,选择该条件的主要原因是 (2分)。
(3)有资料报道:“最近研制出一种性能优越的催化剂,可以将SO2全部催化氧化为SO3。”
你认为该报道可信吗? (2分)(填“可信”或“不可信”),其理由是
(2分)。
(4)合成氨时,原料N2不能用空气代替,主要原因是 (2分)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com