
题目列表(包括答案和解析)
25.(11分)奥美拉唑(Omeprazole)是基于2005年诺贝尔医学奖成果研制的药物,该药物对幽门螺旋杆菌引起的胃及十二指肠溃疡根治率最高。奥美拉唑的合成路线如下(Me表示甲基):
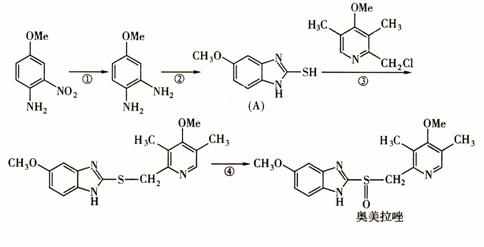
试回答下列问题:
(1)奥美拉唑的分子式是: 。
(2)指出下列反应的类型:① ;③ 。
(3)反应②是与一种无机小分子在氢氧化锂催化下发生的反应,二者各一分子反应在得到A的同时还得到一分子的硫化氢,则该无机小分子的化学式为: 。
(4)反应④是用液态氧化剂氧化而发生的反应,除生成奥美拉唑外还生成水,请写出④的化学反应方程式: 。
(5)根据结构判断奥美拉唑可能发生的化学反应是: 。
A.与氢氧化钠发生水解反应 B.能与氯气发生加成反应
C.与乙酸发生酯化反应 D.能使酸性高锰酸钾溶液褪色
24.(9分) 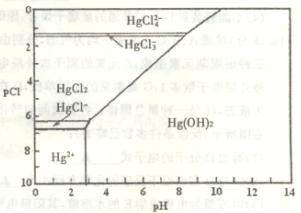 水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与
水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与 、
、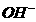 的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=一lgc(
的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=一lgc(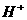 ),pCl=一lgc(
),pCl=一lgc( )]。
)]。
(1)正常海水(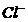 的浓度大于0.1mol/L) 中汞元素的主要存在形态是
。
的浓度大于0.1mol/L) 中汞元素的主要存在形态是
。
少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是 。
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是 (用离子方程式表示) ,为了防止出现浑浊,可采取的措施是 。
(3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含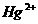 的废水。反应的离子方程式为
。
的废水。反应的离子方程式为
。
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。已知
Ksp(HgS)=1.6×10-52(mol/L)2,当废水中c(S2-)=1×10-5mol/L时,c(Hg2+)= 。
23.(14分)下图是工业生产硝酸铵的流程。
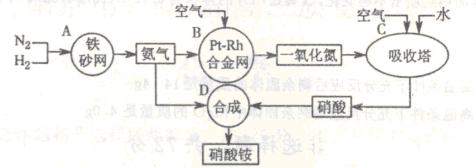
(1)吸收塔C中通入空气的目的是 。A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=一1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知:N2(g)+3H2(g)  2NH3(g) △H=一92 kJ/mol。
2NH3(g) △H=一92 kJ/mol。
为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气和氢气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为 。
22.(8分)单质A、B、C在常温下均为气态,分别由X、Y、Z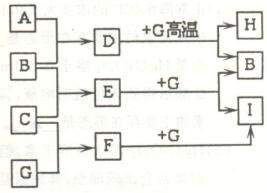 三种短周期元素组成;Z元素的原子次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色固体。各物质间的转化关系如右图所示(反应条件多数已略去);
三种短周期元素组成;Z元素的原子次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色固体。各物质间的转化关系如右图所示(反应条件多数已略去);
(1)写出D分子的电子式 。
(2)G与D在高温下反应的化学方程式为 。
(3)以石墨为电极电解E的水溶液,其阳极电极反应式为 。
(4)实验室检验F的水溶液中所含金属阳离子的操作方法、现象和结论是 。
21.(10分)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上制备无水AlCl3的方法是:将一定粒度的铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按一定配比投入焙烧炉中加热至800℃,再将焙烧过的物料投入到氯化炉中,然后通入Cl2和O2,于950℃在石油焦还原剂的存在下,Al2O3跟Cl2反应,生成气态的AlCl3,经冷却后得到氯化铝粗产品(杂质的成分是FeCl3)。尾气中含有大量CO和少量Cl2,用碱液或Na2SO3溶液除去Cl2,并回收CO。精制AlCl3粗产品一般用升华法。在升华器内,加入NaCl固体,同时加入少量某种物质X,将FeCl3杂质还原成Fe作为废渣除去,再经升华就得到精制的AlCl3。回答下列问题:
(1)氯化炉中通入O2的目的是 。
(2)氯化炉中Al2O3、C12和C反应的化学方程式是 。
(3)用Na2SO3溶液处理尾气时发生反应的离子方程式是 。
(4)精制AlCl3粗产品时,需加入少量物质X。X可能是下列物质中的 。(填字母)
A.FeCl2固体 B.Fe粉 C.Al粉
(5)精制无水AlCl3合格品中,AlCl3的质量分数不得低于96%。现称取16.25g精制后的无水 AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。试计算该样品中AlCl3的质量分数(写出计算过程,并注意相应单位的数值的小数位)。
20.(15分)硝酸钾在水里的溶解度是指在一定温度下,硝酸钾在100g水中达到饱和状态时能溶解的克数。它随温度的升高而增大,随温度的降低而减小。把一定量硝酸钾在较高温度下溶于一定量的水中,当温度降到溶液里刚有晶体析出时,这时的温度可作为饱和溶液的温度(或在恒温下制成饱和溶液)。根据测得的温度和已知硝酸钾及水的量,就能算出硝酸钾在某一温度的溶解度。
[实验步骤] (1) 准确称量(天平)干燥的蒸发皿的质量并记录为m1g;
(2) 在恒温水浴加热下,配制硝酸钾饱和溶液;
(3) 取一定量的硝酸钾饱和溶液用倾析法倾入蒸发皿中,称量并记录为m2g;
(4) 加热蒸发皿中的溶液至蒸干,放入干燥器内冷却后称量并记录为m3g;
(5) 根据上述公式计算S;
(6) 重复上述操作,取两次测定结果的平均值。
根据实验,回答下列问题:
(1) 配制硝酸钾的饱和溶液时,必须水浴加热,原因是_________________。
(2) 请在答卷方框内画出制取硝酸钾饱和溶液实验装置图,并注明容器内的所用试剂。(铁架台、铁夹、石棉网、酒精不需要画出)
 为了保证溶液达到饱和,实验操作是_______________________。 如果实验过程中把蒸发皿放在空气中冷却,没有在干燥器中冷却,会造成实验结果________(“偏高”、“偏低”、“不变”);使用温度计时仰视温度计刻度读数,会造成实验结果________(“偏高”、“偏低”、“不变”)。
为了保证溶液达到饱和,实验操作是_______________________。 如果实验过程中把蒸发皿放在空气中冷却,没有在干燥器中冷却,会造成实验结果________(“偏高”、“偏低”、“不变”);使用温度计时仰视温度计刻度读数,会造成实验结果________(“偏高”、“偏低”、“不变”)。
(3) 请计算在该温度下溶解度为s=______________________________
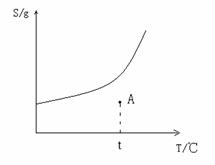
(4) 右图中A点表示t℃时该溶液为_____________(“饱和”、“不饱和”)溶液,欲将A点的溶液恢复到饱和溶液,应采取的措施是①_____________________,②______________(写两条)
(5)如果硝酸钾中含有少量氯化钠杂质,如何除去,请扼要写出实验步骤_______。
18.工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);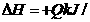 mol(Q>0)
mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
17.氮化铝(AlN)具有耐高 温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3+N2+3C == 2AlN+3CO 下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2molAlN,N2得到的3mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
16.在pH为4-5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法正确的是
A.加入纯Cu将Fe2+还原
B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4-5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com