
题目列表(包括答案和解析)
18.将30mL NO2和O2的混合气体通入倒置于水槽且装满水的量筒中,充分反应后,量筒内剩余5mL气体,则原混合气体的体积组成是
A.NO2:20mL;O2:10mL B.NO2:27mL;O2:3mL
C.NO2:15mL;O2:15mL D.NO2:25mL;O2:5mL
17.某氢氧燃料电池(用氢氧化钾水溶液为电解质溶液),用该电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是
A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B.电池的正极反应式为:O2十2H2O十4e-==4OH-
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电解池中溶液pH变大
16.下列溶液中离子浓度的关系正确的是
A.0.10 mol/L NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.0.20 mol/L Na2CO3溶液和0.20 mol/L NaHCO3溶液等体积混合后:
c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C.向0.10 mol/L 硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-)
D.0.10 mol/L 醋酸钡溶液中:c(Ba2+)=c(CH3COO-)+c(CH3COOH)
15.物质的量浓度相同,体积相同的下列溶液中,吸收SO2气体的量最多的是
A. NH3·H2O B.Na2CO3 C.Na2S D.Ba(OH)2
14.常温下在10mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于 7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(A-)=c(K+) B.c(H+)=c(OH-)<c(K+)<c(A-)
C.V总≥20mL D.V总≤20mL
13.三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥 皂、牙膏等日用化学品之中,有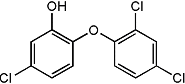 杀菌消毒等作用。则下列有关说法中正确的是
杀菌消毒等作用。则下列有关说法中正确的是
A.物质的分子式为C12H6Cl3O2
B.该物质与FeCl3溶液混合后可显色。
C.该物质中所有原子一定处于同一平面
D.该物质苯环上的一溴取代物有6种
12.单质钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有:
① FeTiO3 +2H2SO4=TiOSO4+ FeSO4 +2H2O ② TiOSO4 +2H2O=H2TiO3↓+H2SO4
③ H2TiO3 TiO2+H2O
④ TiO2 +2C +2Cl2
TiO2+H2O
④ TiO2 +2C +2Cl2 TiCl4+2CO
TiCl4+2CO
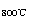 ⑤ TiCl4 +2Mg
⑤ TiCl4 +2Mg  2MgCl2
+Ti
2MgCl2
+Ti
下列叙述正确的是
A. 反应①是氧化还原反应 B. 反应②是水解反应
C. 反应④中TiO2是氧化剂 D. 反应⑤需在N2的保护下进行
11.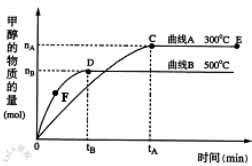 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)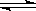 CH3OH(g),根据题意,以下说法正确的是
CH3OH(g),根据题意,以下说法正确的是
A.E点的平衡常数大于D点的平衡常数,且
该反应的ΔH>0
B.容器中气体的总物质的量E点大于D点
C.F点的正反应速率大于逆反应速率
D.v(甲醇)=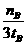 mol/(L•min)表示500℃时以上反应在D点的速率
mol/(L•min)表示500℃时以上反应在D点的速率
意若正确答案只包括一个选项,多选时,该题为0;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
10.NA表示阿伏加德罗常数。下列说法中,正确的是
A.标准状况下,H2和O2各11.2L相混合,混合气体所含分子总数为NA
B.1.8g的NH4+中,所含电子总数为NA
C.7g乙烯和丙烯的混合物中,所含原子总数为NA
D.1 mol·L-1的NaOH溶液中,所含Na+总数为NA
9.X、Y、Z、W四种主族元素,若:X的阳离子与Y的阴离子具有相同的电子层结构;W 的 阳离子氧化性大于等电荷数的X阳离子的氧化性;Z的阴离子半径大于等电荷数的Y的阴离子半径,则四种元素的原子序数由大到小排列的顺序是
A.Z>X>Y>W B.W>X>Y>Z C.X>Z>Y>W D.Z>Y>X>W
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com