
题目列表(包括答案和解析)
27.(10分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
a |
|
|
|||||||||||||||
|
b |
|
|
|
c |
d |
e |
f |
|
|||||||||
|
g |
h |
i |
j |
|
k |
l |
m |
||||||||||
|
n |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)元素o为26号元素,请写出其基态原子电子排布式 。
(2)k在空气中燃烧产物的分子中中心原子的杂化形式为 ,
该分子是 (填“极性”或“非极性”)分子。
(3)h 的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因: 。
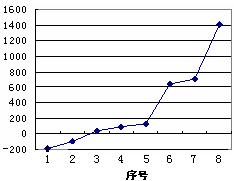 (4)第三周期8种元素按单质熔点(℃)高低的
(4)第三周期8种元素按单质熔点(℃)高低的
顺序如右图,(已知序号“1”代表Ar),其中序号
“8”代表 (填元素符号);其中电负性最
大的是 (填右图中的序号)。
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
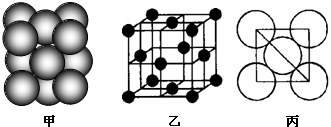
请回答:
①晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 。
2009届高三水平测试·化学
答案及说明
26.(10分)有机物A有如下变化,其中只有B1既能使溴水褪色,又能和Na2CO3溶液反应生成CO2。
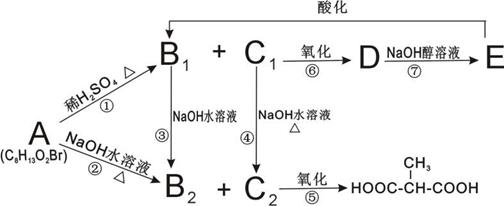
(1)C1中含有的官能团有______________________________________。
(2)已知CH2=CH-OH不稳定,写出B1既可以发生银镜反应,又可以与金属钠发生反应的所有链状同分异构体的结构简式:
______________________________________________________________________________。
(3)写出A与C2两种物质的结构简式:
A______________________________________;C2__________________________________。
(4)写出反应①与③的反应类型:①______________________;③___________________。
(5)写出反应②的化学方程式___________________________________________________。
25.(10分)近年来,国际原油价格大幅上涨,促使各国政府加大生物能源生产,其中酒精汽 油已进入实用化阶段。
(1)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X可发生银镜反应,请写出X被银氨溶液氧化的反应方程式(标出具体反应条件):
。
(2)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y 含有官能团的名称是______。在浓硫酸作用下,乙醇与Y反应可生成一种有香味的物质W,化学方程式为
______________________________________________________________________。
 (3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是
(3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是
或 。
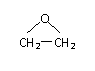
(4)现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷 ,该
反应的原子利用率为100%,反应的化学方程式为 。
(5)工业上可以以淀粉为原料,经水解得葡萄糖,葡萄糖发酵制取乙醇。
写出葡萄糖发酵制取乙醇的化学反应的方程式 。
24.(10分)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)现将2mol SO2(g)、1mol O2(g)充入一密闭容器充分反应生成SO3 (g)后,放出热量98.3 kJ,此时测得SO2的转化率为50%, 该反应的热化学方程式为:
。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
 2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度改变的是
2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度改变的是
(填字母)。
A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器内压强不变,充入1mol SO3
C.保持温度和容器内压强不变,充入1mol SO2和0.5mol O2
D.保持温度和容器内压强不变,充入1mol Ar
 (3)某温度下,反应2SO2(g)
+ O2(g)
2SO3(g) 在10.0L的密闭容器中进行,问:
(3)某温度下,反应2SO2(g)
+ O2(g)
2SO3(g) 在10.0L的密闭容器中进行,问:
反应开始前向容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时,
混合气体总物质的量为13.0mol。计算(写出计算过程):
①SO2的平衡转化率是多少?
 ②该条件下反应2SO3(g) 2SO2(g)
+ O2(g) 的平衡常数K。
②该条件下反应2SO3(g) 2SO2(g)
+ O2(g) 的平衡常数K。
23.(13分)
红钒钠(重铬酸钠:Na2Cr2O7·2H2O,橙红色晶体)是重要的化工原料。工业铬铁矿(FeO·Cr2O3,含少量Al2O3和SiO2)按以下过程来制取红钒钠。

(1)步骤I的反应有:4( FeO· Cr2O3)+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2;生成1mol Na2CrO4转移的电子数为 mol;
原料中加入CaCO3的作用是 (填字母)。
A.分解产生CaO,与某些杂质反应形成炉渣
B.分解时放出大量热量,提高煅烧温度
C.分解产生CO2从下而上穿过,使得炉料翻滚,使原料充分、快速被煅烧氧化
(2)浸取液中含有铝和硅的化合物,步骤III过滤前要用稀H2SO4将浸取液的pH调至7-8,并煮沸除去铝和硅的化合物,其离子方程式为:
。
(3)步骤IV反应的离子方程式为: 。
下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线:
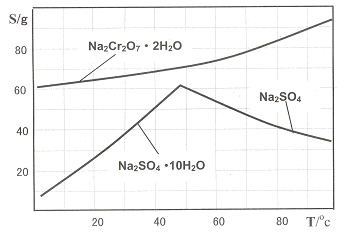
(4)据此,步骤V操作的方法是:将IV所得溶液 (填操作方法),趁热过滤得到的晶体是 (填化学式);然后将所得溶液 (填操作方法),得到的晶体是 (填化学式)。
(5)若在实验室进行“趁热过滤”,可采取的措施是
(写出一种)。
22.(10分)草酸(H2C2O4)是一种二元弱酸,它在水溶液中的存在形式的分布与pH关系如 下图所示:
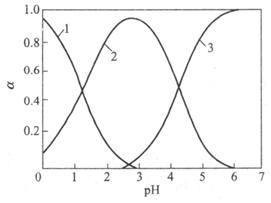
1- H2C2O4 2- HC2O4- 3- C2O42-
(1)欲采用草酸为沉淀剂测定钙离子(生成CaC2O4)沉淀)时,溶液的pH值应维持在(填字母) 。
A. 0~1 B. 1~3 C. 3~5 D. ≥5
(2)Na2C2O4溶液中,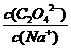
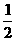 (填“>”、“<”或“=” =)。
(填“>”、“<”或“=” =)。
(3) H2C2O4是用来标定KMnO4常用的基准物质,一般开始滴定时,控制溶液的c(H+)大约为0.5~1mol/L,该滴定反应的离子方程式为 。
(4)用H2C2O4标定KMnO4时,应将溶液加热至75~85℃,不在此温度范围时不利于滴定分析,理由是 。
(5)下表为物质的量浓度相同的几种酸对铁锈及锅炉水垢的溶解性的比较:
|
酸 |
铁锈[Fe(OH)3]溶解量/g |
水垢(CaCO3)溶解量/g |
|
盐酸 |
0.7911 |
全溶 |
|
磷酸 |
0.1586 |
微溶 |
|
草酸 |
0.7399 |
0.0036 |
|
醋酸 |
0.1788 |
0.1655 |
下列推断可能正确的有 (填字母)。
A. 酸性越强的酸除铁锈效果越好
B. 草酸除水垢效果差的原因是因为草酸酸性太弱
C. 铁锈或水垢在酸中的溶解性与酸根离子的性质可能有关
D. 硫酸除铁锈和水垢的效果都好
(3)请设计实验方案进一步确定该固体混合物的组成。叙述实验操作、预期现象和结论。
|
实验操作 |
预期现象和结论 |
|
|
|
|
|
|
21.(16分)下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及 夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
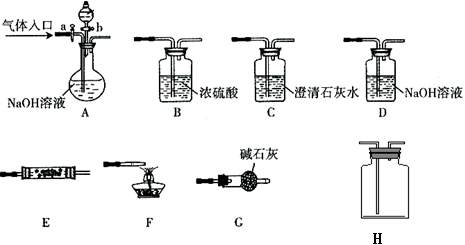
(1)实验前,如何检查A装置的气密性: 。
(2)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(3)若A中气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,H为空瓶,D中改为石蕊试液,按A→G→E→H→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有 。
②实验中先用酒精灯加热催化管,再通入混合气体,可观察到H内有红棕色气体出现,D中石蕊试液变红,则E中发生反应的方程式为 。
③若把酒精灯撤去,继续通入气体,催化剂可继续保持红热状态,反应继续进行。能使催化剂继续保持红热的原因是: 。
④某同学在做上述实验时出现了与其他同学不同的现象,他发现催化剂红热现象明显而正常,但石蕊试液不变红。请分析可能的原因:(答两点即可)
。
取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味。用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)用 (填实验用品名称)取固体混合物于烧杯中。
(2)上述实验可以得到的初步结论是 。
20.(10分)已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物 质中的两种。请完成下述探究混合物组成的实验。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子、蒸发皿;红色石蕊试纸、淀粉碘化钾试纸;1mol/L硫酸、1mol/L硝酸、1mol/L盐酸、1mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
19.(8分)酸碱中和滴定常用于测定酸碱溶液浓度。
(1)实践中,在正式测定前,常常用已知浓度的酸(或碱)滴定已知浓度的碱(或酸),测定滴定曲线,然后选择合适的指示剂指示滴定终点,以保证数据的准确性。如:用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L 醋酸(HAc)溶液,有关数据记录如下表:
|
V(NaOH) /mL |
0.00 |
10.00 |
18.00 |
19.80 |
19.98 |
20.00 |
20.02 |
20.20 |
22.00 |
40.00 |
|
溶液pH |
2.87 |
4.74 |
5.70 |
6.74 |
7.74 |
8.72 |
9.70 |
10.70 |
11.70 |
12.50 |
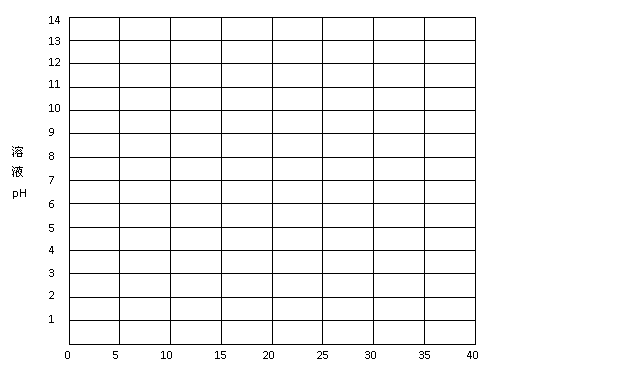 ①根据上表数据绘制0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L 醋酸(HAc)溶液的滴定曲线。
①根据上表数据绘制0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L 醋酸(HAc)溶液的滴定曲线。
②根据本题数据,确定pH的突变范围是 。
③下列指示剂中适合于本实验的是 (填字母)。
A.甲基橙 B.石蕊 C.酚酞
(2)可用酸式滴定管准确量取0.1000mol/L的醋酸溶液。在调节酸式滴定管的起始读数时,要使滴定管的尖嘴部分充满醋酸,如果滴定管内部有气泡,赶走气泡的操作是 。
(3)滴定过程中,眼睛应注视着 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com