
题目列表(包括答案和解析)
1.美国和墨西哥研究人员将普通纳米银微粒分散到纳米泡沫碳(碳的第五种单质形态)中,得到不同形状的纳米银微粒,该纳米银微粒能有效杀死艾滋病病毒(HIV-1)。纳米泡沫碳与金刚石的关系是
A.同素异形体 B.同分异构体 C.同系物 D.同位素
27.(10分)(1)1s22s22p63s23p63d64s2
(2)sp2 极性
(3)电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量。
(4) Si 2
(5) 12 4 (每小题2分)
26.(10分)
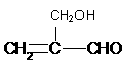 (1)羟基;溴原子 (1分)
(1)羟基;溴原子 (1分)
(2)CH2=CHCHOHCHO;CH2OHCH=CHCHO; (共3分)
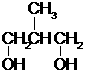
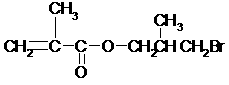 (3)
(3)
A: C2: (共2分)
(4)取代或水解;中和(共2分)
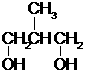
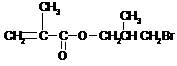
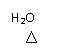
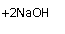

 (5)(共2分)
(5)(共2分)
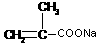
+NaBr+H2O
25. (10分)
(10分)
(1)CH3CHO + 2Ag(NH3)2OH
CH3COONH4 + 2Ag ↓+ 3NH3↑ + H2O
+ 2Ag(NH3)2OH
CH3COONH4 + 2Ag ↓+ 3NH3↑ + H2O
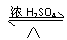 (2分)
(2分)
(2)羧基(1分) CH3COOH +CH3CH2OH CH3COOCH2CH3+H2O(2分)
(3) 紫色石蕊试液(或碳酸钠溶液等其他合理答案) (每空1分)
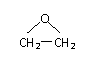
 (4) 2CH2=CH2
+ O2
(4) 2CH2=CH2
+ O2  2
(1分)
2
(1分)
 (5)
(5)
 C6H12O6
2C2H5OH + 2CO2 ↑ (2分)
C6H12O6
2C2H5OH + 2CO2 ↑ (2分)
24.(10分)
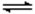 (1) SO2(g)+1/2O2(g)
SO3(g); △H = -98.3kJ/mol
(1) SO2(g)+1/2O2(g)
SO3(g); △H = -98.3kJ/mol
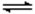 或
2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol
或
2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol
(2分)
(2)AD (2分) (3) 设反应中转化的氧气量为xmol
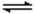 2SO2(g) + O2(g)
2SO3(g)
2SO2(g) + O2(g)
2SO3(g)
起始物质的量(mol) 4.0 10.0 0
转化的物质的量(mol) 2x x 2x
平衡时物质的量(mol) 4.0-2x 10.0-x 2x
平衡时:[(4.0-2x)+ (10.0-x)+ 2x]mol=13.0 mol(1分) 解得x=1.0 (1分)
SO2的转化率=(2x1.0mol/4.0mol)x100%=50% (1分)
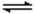 反应2SO3(g) 2SO2(g)
+ O2(g) 的
反应2SO3(g) 2SO2(g)
+ O2(g) 的
平衡浓度(mol/L) 2x1.0/10 (4.0-2.0)/10 (10.0-1.0)/10
平衡常数K
K=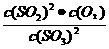 =
=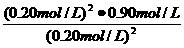 =0.90mol/L (3分)
=0.90mol/L (3分)
23.(共13分)
(1) 3.5 (2分) A C (2分)
(2)AlO2- + H+ + H2O = Al(OH)3↓(或Al(OH)4- + H+ = Al(OH)3↓+ H2O)
SiO32-+ 2H+ + = H2SiO3↓(或SiO32-+ 2H+ + H2O = H4SiO4↓) (每式1分,共2分)
(3)2CrO42-+2H+= Cr2O72-+H2O (1分)
(4)蒸发浓缩,Na2SO4 (答Na2SO4•10H2O也给分),冷却结晶、过滤,Na2Cr2O7·2H2O
(每点1分,共5分)
(5)预热过滤装置(或用常压热过滤漏斗进行过滤)。(1分)
22.(10分)
(1)D
(2)<
(3)2 MnO4- +5 H2C2O4 +6H+ ====2 Mn2+ +10CO2↑+8H2O
(4)温度过低反应速率缓慢;温度过高时,H2C2O4在酸性溶液中会部分分解。
(5)C (每个点2分)
21.(16分)
(1)关闭活塞a、b,将出气导管口浸没在液面以下(1分),用手掌或热毛巾紧贴烧瓶外壁一小会儿(1分),若出气导管口有气泡冒出,松手或拿走热毛巾后导管内回升一段水柱,证明A装置不漏气(1分)。(共3分)
(2)ACBECF(2分);AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊(2分)。
(3)①氢氧化钠遇水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出。(2分)
②
4NH3十5O2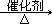 4NO+6H2O(2分)
③说明氨的氧化反应是一个放热反应 (2分)
4NO+6H2O(2分)
③说明氨的氧化反应是一个放热反应 (2分)
④H、D部分装置的气密性不好;或NH3过量;或H瓶不干燥,生成的二氧化氮溶于水。(答对一点给2分,答对2点给3分)
20.(10分)
(1)药匙(1分)(错别字不得分) 。
(2)该混合物中肯定含有NH4HCO3(1分),肯定不含有CuSO4 (1分)
或该混合物的组成为NH4HCO3和(K2SO4或NH4Cl或NaCl)三者之一的混合物。
(3)
|
实验操作 |
预期现象和结论 |
|
向溶液B中滴加少量Ba(NO3)2溶液。(1分) |
如果产生白色沉淀,说明原固体混合物中含有K2SO4;(1分)该混合物的组成为NH4HCO3和K2SO4 如果没有白色沉淀产生,说明原固体混合物中不含K2SO4,(含有NaCl或NH4Cl。) (1分) |
|
若固体混合物不含K2SO4(该句可以不写),取少量原固体混合物于试管,(1分) 将试管套入试管夹,用火柴点燃酒精灯,充分加热。(1分) |
如果试管底部有固体残留,说明混合物中含有NaCl;(1分)该混合物的组成为NH4HCO3和NaCl; 如果试管底部无固体残留,说明混合物中含有NH4Cl;(1分)该混合物的组成为NH4HCO3和NH4Cl |
(操作描述中未强调用量总共合扣1分。用焰色反应等限定用品以外的方法不得分。K2SO4的检验如果取样溶液A或原固体加水溶解不扣分。NaCl或NH4Cl的检验若取溶液检验则4分全扣,对加热后的残留固体、试管口凝结的固体作出进一步检验的不扣分。)
以下回答同样得分:
|
实验操作 |
预期现象和结论 |
|
取少量原固体混合物于试管底部,(1分) 将试管套入试管夹,用火柴点燃酒精灯,充分加热试管。(1分) |
如果试管底部有固体残留,说明混合物中含有K2SO4或NaCl;(1分) 如果试管底部无固体残留,说明混合物中含有NH4Cl;(1分) |
|
如果加热后试管底部有固体残留(该句可以不写),取残留固体加水溶解,滴加少量Ba(NO3)2溶液。(1分) |
如果产生白色沉淀,说明原固体混合物中含有K2SO4;(1分) 如果没有白色沉淀产生,说明原固体混合物中含有NaCl。(1分) |
19.(8分)
(1)①略(2分) ②7.74-9.70(2分) ③C(1分)。
(2)快速放液。(2分)
(3)锥形瓶内溶液颜色的变化。(1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com