
题目列表(包括答案和解析)
21.(7分)A、B、C属于周期表前4周期的元素,它们的原子序数依次增大。A、B属于同一周期,A、C是生活中常见的金属元素。C的原子序数是A的2倍,B的单质常温下为黄色粉末。
(1)C在周期表中位于___________周期____________族。
(2)在加热条件下B单质与C单质反应的化学方程式是____________________________________。
(3)A的氧化物是某矿物的主要成分,由该矿物提取A元素的第一步是用NaOH溶液处理矿物,使A元素变为可溶性盐,该反应的离子方程式是___________________________________________。
(4)B与C形成的化合物CB2,在有水存在的条件下用氧气氧化该化合物,得到强酸性溶液,低温下 从该强酸性溶液中还可结晶出浅绿色的C的低价盐,该氧化还原反应的化学方程式是_______________________________________________。
20.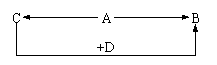 (5分)A、B、C、D为四种由短周期元素形成的化合物,它们的焰色反应均为黄色,并有下列转化关系。A中既含有离子键又含有非极性共价键,D含四种元素。
(5分)A、B、C、D为四种由短周期元素形成的化合物,它们的焰色反应均为黄色,并有下列转化关系。A中既含有离子键又含有非极性共价键,D含四种元素。
(1)A的电子式是_____________________。
(2)把1 molCO2通入含2 molC的溶液后,溶液中各离子浓度由大到小的顺序是________________。
(3)1 molA与2 molD固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体 是_____________________(用化学式表示)。
19.(5分)现有下列8种物质:①Na2CO3 ②NaHCO3 ③C6H5ONa ④NH4HCO3 ⑤C2H5OH ⑥Al ⑦食盐水 ⑧CH3COOH
(1)上述物质中属于强电解质的是_________________(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是________________(填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示)__________________________________。
(3)④跟足量的NaOH浓溶液在加热条件下反应的离子方程式是______________________________。
18.已知NO2和N2O4可以相互转化:2NO2(g) 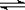 N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
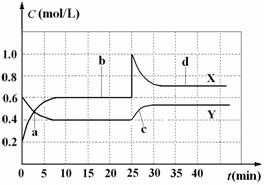 A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化
A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4
D.若要达到与d相同的状态,在25 min时还能采取的措施是适当缩小容器体积
选择题答卷纸
请将你选定的答案在答卷纸上涂黑,如■
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
[A] |
|
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
[B] |
|
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
[C] |
|
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
[D] |
第Ⅱ卷(非选择题 共56分)
17.常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中水电离出的c(H+)=1×10-10 mol·L-1
B.该溶液中c(H+)+c(A-)+c(HA)=0.1 mol·L-1
C.该溶液与0.05 mol·L-1 NaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)
D.向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
16.常温下,在溶液中可发生以下反应:①16H +10Z
+10Z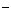 +2XO
+2XO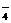 =2X
=2X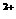 +5Z2 +8H2O,
+5Z2 +8H2O,
②2M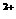 +R2=2M
+R2=2M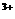 +2R-,③2R-+Z2=R2+2Z-,由此判断下列说法错误的是
+2R-,③2R-+Z2=R2+2Z-,由此判断下列说法错误的是
A.氧化性强弱顺序为: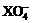 <Z2 <R2 <M
<Z2 <R2 <M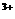
B.还原性强弱顺序为:X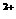 <Z
<Z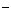 <R
<R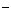 <M
<M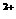
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2=2M3++2Z-
15.已知1-18号元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A.质子数:c>b B.氢化物的稳定性:H2Y<HZ
C.离子的还原性:Y2-<Z- D.原子半径:r(X)<r(W)
14.下列关于热化学反应的描述中正确的是
A.已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1,
则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ·mol-1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);
△H=-192.9 kJ·mol-1,则CH3OH的燃烧热为192.9 kJ·mol-1
C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g);△H=+571.6 kJ·mol-1
D.葡萄糖的燃烧热是2800 kJ·mol-1,则1/2 C6H12O6 (s)+3O2 (g)=3CO2 (g)+3H2O ( l );
△H=-1400 kJ·mol-1
13. 铅蓄电池在现代生活中具有广泛的应用。已知铅蓄电池的电解质溶液为H2SO4溶液,其充电、放电按下式进行:Pb+PbO2+2H2SO4 2PbSO4+2H2O,有关该电池的说法正确的是
铅蓄电池在现代生活中具有广泛的应用。已知铅蓄电池的电解质溶液为H2SO4溶液,其充电、放电按下式进行:Pb+PbO2+2H2SO4 2PbSO4+2H2O,有关该电池的说法正确的是
A.充电时化学能转化为电能
B.放电时溶液中的H+向负极移动
C.充电时电池的正极与电源的正极相连
D.放电时负极反应:PbSO4+2H2O-2e-=PbO2+4H++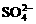
12.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中: 、
、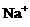 、
、 、
、
B.在强碱性溶液中: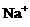 、
、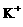 、
、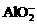 、
、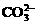
C.在pH=1的溶液中: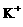 、
、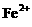 、
、 、
、
D.在无色透明溶液中: 、
、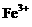 、
、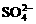 、
、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com