
题目列表(包括答案和解析)
21.(7分)
 (1)四 (1分);Ⅷ (1分)
(1)四 (1分);Ⅷ (1分)
(2)S+Fe ==FeS (1分)
(3)Al2O3+2OH- =2AlO2-+H2O (2分)
(4)2FeS2+7O2+2H2O=2H2SO4+2FeSO4 (2分)
20.(5分)
(1) (1分)
(1分)
(2)c(Na+) > c(CO32-)> c(OH-) >c(HCO3-) >c(H+) (2分)
(3)Na2CO3 (2分)
19.(5分)
(1)①②③④(1分);②④⑥ (1分)
 (2)HCO3-+H2O
(2)HCO3-+H2O 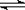 H2CO3+
OH- (1分)
H2CO3+
OH- (1分)
(3)NH4++HCO3-+2OH-==CO32-+NH3↑+2H2O(2分)
11.B 12.B 13.C 14.D 15.B 16.A 17. D 18.C
1.A 2.D 3.C 4.A 5.B 6.C 7.A 8.D 9.C 10.D
26.(9分)为了预防碘缺乏病,国家规定每千克食盐中应含有40 mg~50 mg的碘酸钾。为检验某种食盐是否为合格的加碘食盐,某同学取食盐样品428 g,加水溶解。将得到的溶液用足量的稀硫酸酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色。再将该溶液用0.03 mol·L-1的硫代硫酸钠溶液滴定,当消耗18.00 mL硫代硫酸钠溶液时,溶液的蓝色刚好褪去,反应的离子方程式是I2+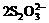 =2I-+
=2I-+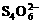 。
。
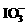 (1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的 ,配平离子方程式。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的 ,配平离子方程式。
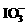 ______ +______I-+______H+=______I2+______H2O
______ +______I-+______H+=______I2+______H2O
(2)若要检验食盐中是否含有K+,实验操作是_____________________________________________ _________________________________________________。
(3)工业上用石墨和铁为电极电解KI溶液制取KIO3。电解时,铁做______(填“阳极”或“阴极”), 石墨电极上的电极反应式是______________________________________,电解过程中铁电极附近溶液的pH__________(填“变大”、“变小”或“不变”)。
(4)该食盐样品中KIO3的含量是___________mg·kg-1。
北京市西城区抽样测试
高三化学试卷答案及评分标准 2009.1
25.(6分)在一定温度下,向容积不变的容器中加入2 mol N2、8 mol H2 及固体催化剂,使之反应。已知:N2(g)+3H2(g)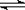 2NH3(g);△H=-92.2 kJ·mol-1。平衡时,容器内气体压强为起始时的80%。
2NH3(g);△H=-92.2 kJ·mol-1。平衡时,容器内气体压强为起始时的80%。
(1)反应达到平衡时,放出的热量__________。
A.小于92.2 kJ B.等于92.2 kJ C.大于92.2 kJ
(2)保持同一温度,在相同的容器中,若起始时加入2 mol NH3、1mol H2 及固体催化剂,反应达到平 衡时NH3的体积分数_______________。
A.等于0.25 B.大于0.25 C.小于0.25
 (3)保持同一温度,在相同的容器中,起始通入一定物质的量N2、H2、NH3,欲使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则充
入N2的物质的量a(mol)的取值范围是______________。
(3)保持同一温度,在相同的容器中,起始通入一定物质的量N2、H2、NH3,欲使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则充
入N2的物质的量a(mol)的取值范围是______________。
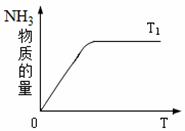
(4)右图是T1℃时容器中NH3的物质的量随时间的变化曲线, 请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的 变化曲线。
24.(9分)某同学用含硫酸亚铁等杂质的工业硫酸铜制取纯净的氧化铜以探究其性质。
(1)制备氧化铜
① 将工业硫酸铜加适量水溶解、搅拌、过滤除去不溶性杂质。简述检验滤液中含有Fe2+的 操作方法:_________________________________________________________________。
② 向滤液中滴加H2O2溶液,稍加热,当Fe2+转化完全后,为将Fe3+全部转化为Fe(OH)3沉淀,而不会将Cu2+转化为沉淀,需慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5。加热煮沸后过滤,用稀硫酸酸化滤液至pH=1。再从溶液中分离出硫酸铜晶体。Fe2+转化为Fe3+的离子方程式是__________________________________________。
③ 在测定所得硫酸铜晶体(CuSO4·xH2O)x值的实验中,所用的玻璃仪器名称为:酒精灯、 玻璃棒、_______________,实验过程中称量操作至少进行_______次。
④ 用得到的硫酸铜晶体制氧化铜。
(2)探究氧化铜的性质 在加热条件下,向下图所示装置中持续通入某纯净物X的蒸气,a处黑色物质变为红色,
b处白色粉末变为蓝色,c处有无色液体产生。(设各步反应均进行完全)
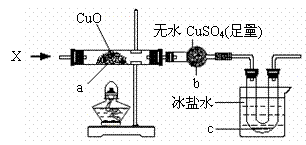
则X可能是_____________________(填一个化学式即可),X与CuO反应的化学方程式是_________________________________________________________。
23.(9分)A与芳香族化合物B在一定条件下反应生成C,进一步反应生成抗氧化剂阿魏酸。
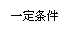 A的相对分子质量是104,1 mol A与足量NaHCO3反应生成2 mol气体。已知:
A的相对分子质量是104,1 mol A与足量NaHCO3反应生成2 mol气体。已知:

 RCHO+CH2(COOH)2
RCH=C(COOH)2+H2O,RCH=C(COOH) 2
RCH=CHCOOH+CO2
RCHO+CH2(COOH)2
RCH=C(COOH)2+H2O,RCH=C(COOH) 2
RCH=CHCOOH+CO2
(1)C可能发生的反应是____________(填序号)。 a.氧化反应 b.水解反应 c.消去反应 d.酯化反应
(2)等物质的量的C分别与足量的Na、NaHCO3、NaOH反应时消耗Na、NaHCO3、NaOH的物质的量之比是___________。
(3)A的分子式是____________。
(4)反应①的化学方程式是_________________________________________________。
(5)符合下列条件的阿魏酸的同分异构体有_____种,写出其中任意一种的结构简式。____________。
①在苯环上只有两个取代基;②在苯环上的一氯取代物只有两种;
③1 mol该同分异构体与足量NaHCO3反应生成2 molCO2。
22.(6分)A、B、C三种香料的结构简式如下。
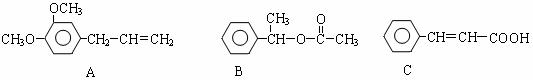
(1)B的分子式是__________________,C中的含氧官能团名称是_____________________________。
(2)A在一定条件下可转化为一种高分子化合物,该化合物的结构简式是_______________________。
(3)C经过下列反应得到E。在一定条件下,两分子E之间发生反应生成六元环酯F。
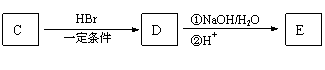
E→F的化学方程式是____________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com