
题目列表(包括答案和解析)
27.(10分)科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是 (填序号)
A. 同种单质 B. 同位素 C. 同分异构体 D. 同素异形体
(2)N4H4(SO4)2 (填“能”或“不能”)和草木灰混合施用
(3)已知白磷.NH4+.N4H44+的空间构型均为四面体, 的结构式为
的结构式为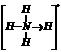
(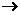 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为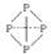 ,请画出N4H44+的结构式
;
,请画出N4H44+的结构式
;
(4)已知液氨中存在着平衡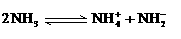 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:
;
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:
;
(5)含有一定量(NH4)2SO4和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
加酸时: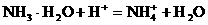 加碱时:
加碱时: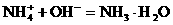
由于(NH4)2SO4和NH3·H2O的大量存在,加少量酸或碱时,溶液中C(H+)与C(OH-)基本保持不变;
含有一定量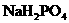 和
和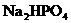 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时 ;加碱时 。
26.(10分)光刻胶是大规模集成电路.印刷电路板和激光版技术中的关键材料。某一肉桂酸型光刻胶的主要成分A经光照固化转变为B。
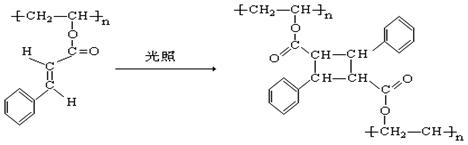
A B
⑴请写出A中含有的官能团名称 。
⑵A经光照固化转变为B,发生了 反应(填反应类型)。
⑶写出A与NaOH溶液反应的化学方程式 。
⑷写出B在酸性条件下水解得到的芳香族化合物的分子式 。
25.(10分)2005年诺贝尔化学奖授予在发现有机物合成转换方面做出杰出贡献的三名科学家。他们获奖的原因是对有机化学烯烃复分解反应的研究做出贡献:弄清了如何指挥烯烃分子“交换舞伴”,将分子部件重新组合成新的物质。对于烯烃复分解反应的研究是通往“绿色化学”的重要一步。烯烃的复分解反应也称之为烯烃的歧化反应,反应机理可表示为:

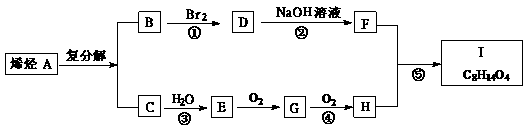 已知同温同压时,C相对于氢气的密度为14,I的分子式为C8H14O4,试根据下图关系,回答问题:
已知同温同压时,C相对于氢气的密度为14,I的分子式为C8H14O4,试根据下图关系,回答问题:
(1)化合物D.E.G.F中,具有羟基的是
(2)反应①.②.③.④.⑤中,属于加成反应的是
(3)写出下列化合物的结构简式:A . I
(4)写出反应E→G的化学方程式:
24.(9分)如下图(a)为持续电解饱和CaCl2水溶液的装置(以铂为电极,A为电流表),电解1小时后 Cl-放电完毕,图(b)从1小时起将CO2连续通入电解液中,请在图(b)中完成实验(a)中电流对时间的变化关系图,并回答有关问题。
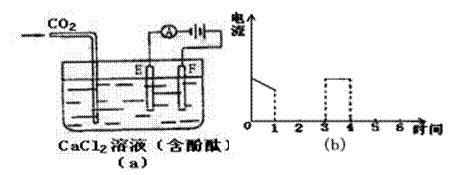
(1)完成实验(a)中电流对时间的变化关系图。
(2)电解时F极发生 反应,电极反应式为 ;
通CO2前电解的总化学方程式为 _______________________ 。
(3)通CO2前电解池中产生的现象:①
② ③ 。
23.(14分)短周期主族元素A.B.C.D.E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大。C.D是空气中含量最多的两种元素;D.E两单质可以生成两种不同的离子化合物。
(1)写出E的单质与A.D两元素形成的常见化合物反应的离子方程式_________。
(2)由A.C.D三元素所形成的常见盐溶液呈_________性(填“酸”.“中”.“碱”),其原因用离子方程式表示为:________________________________________。
 (3)B的相对分子质量最小的氢化物的燃烧热为890.3 kJ·mol-1,写出其燃烧的热化学方程式___________________
(3)B的相对分子质量最小的氢化物的燃烧热为890.3 kJ·mol-1,写出其燃烧的热化学方程式___________________
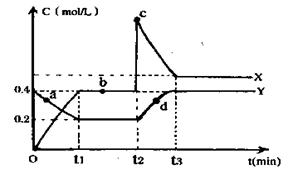
(4)X.Y是均由C.D两元素组成的化合物,且C.D在X.Y中的价态相同,某温度下相互转化时的量变关系如右图: I.X的化学式是______________
Ⅱ.图中a.b.c.d四点中,表示反应处于平衡状态的是_____
Ⅲ.该温度下,反应Y转化为X的平衡常数为 ______________
Ⅳ.反应进行到t2时刻,改变的条件可能是______________。
22.(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3- +4H++3e- = NO+2H2O;KMnO4.Na2CO3.Cu2O.Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式__________________________________。
(2)反应中硝酸体现了 . 性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是 mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
21.(12分)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
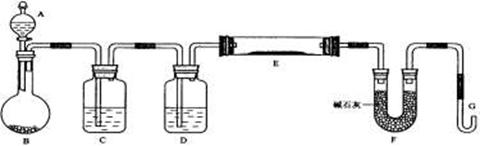
请回答下列问题。
(1)仪器中装入的试剂:
B . C .D ;
(2)连接好装置后应首先 ,其方法是 ;
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是 。在这两步之间还应进行的操作是 ;
(4)反应过程中G管逸出的气体是_______,其处理方法是__________________。
(5)从实验中测得了下列数据:①空E管的质量a ②E管和WO3的总质量b ③反应后E管和W粉的总质量c(冷却到室温称量) ④反应前F管及内盛物的总质量d ⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的计算式(除W外,其他涉及的元素的相对原子质量均为已知):Ar(W)= 。
20.(11分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通 过实验来探究一红色粉末是Fe2O3.Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4。
提出假设:假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是 。
(2)若假设3成立,则实验现象可能是:________________
A.完全溶解无固体存在,溶液不变红色 B.完全溶解无固体存在,溶液变红色
C.有固体存在,溶液不变红色 D.有固体存在,溶液变红色 E.无法确定
(3)若红色粉末是Fe2O3和Cu2O的混合物,放入足量稀硫酸中完全溶解无固体存在,但滴加KSCN试剂后溶液变红色,有关的离子方程式_______________________________.
___________________________________.________________________________。
19.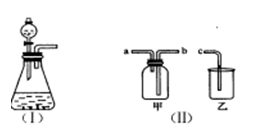 (9分)下图(I)是实验室制取气体的一种发生装置。
(9分)下图(I)是实验室制取气体的一种发生装置。
(1)若用上述装置制取O2,除了可选择二氧化锰和 (物质名称)反应外,还能选择 (填物质的化学式)和水反应。
(2)用排空气法收集H2,可选择图(II)中的甲装置,收集时气体应从 口进气。(填“a”或“b”)
(3)实验室以KMnO4和浓盐酸为反应物,利用(I).(II)装置组合制取氯气,组合装置乙中盛放氢氧化钠溶液,其作用为 。
(4)广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其他简单仪器组成各种用途的装置。如充当集气瓶,还可作 , 。(填写两种即可)
18.25℃时,某物质(无结晶水)溶解度为S g,其摩尔质量为M g/mol,饱和溶液密度为d g/cm3。则其饱和溶液的物质的量浓度为
A.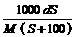 mol/L B.
mol/L B.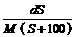 mol/L
mol/L
C.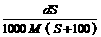 mol/L
D.
mol/L
D.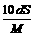 mol/L
mol/L
第Ⅱ卷(非选择题,共83分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com