
题目列表(包括答案和解析)
 如:CH3CHO+2[Ag(NH3)2]++2OH-
如:CH3CHO+2[Ag(NH3)2]++2OH-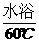 CH3COO-+NH4++3NH3+2Ag +H2O
CH3COO-+NH4++3NH3+2Ag +H2O
21.(10分)硫铁矿在高温下被空气氧化产生二氧化硫:4FeS2+11O2=8SO2+2Fe2O3。设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00 mol FeS2完全氧化,需要空气的体积(标准状况)为________L。
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为_______L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2的氧化产生的气体混合物为100 L,其中O2为aL,SO2为b L,写出a与b的关系式。
20.(10分)某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼金属铜,在炼铜炉内发生如下反应(在高温条件下进行):2Cu2S+3O2 = 2Cu20+2S02; 2Cu20+Cu2S = 6Cu+SO2
(1)若生产38.4t金属铜,需要含杂质20%的精辉铜矿多少吨(设杂质不参加反应)?
(2)若(1)中产生的二氧化硫用于制硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?
19. (8分)工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7% O2 11% N2 82%);
(8分)工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7% O2 11% N2 82%);
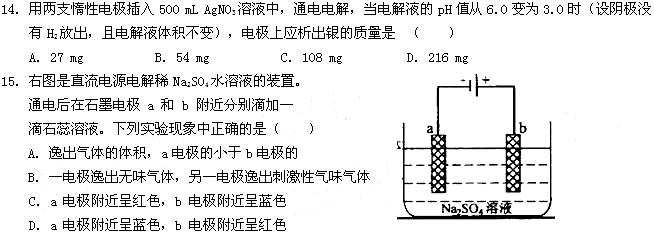
(1)已各SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量 (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)  2SO3(g);△H=-196.9kJ·mol-1,计算每生产1
2SO3(g);△H=-196.9kJ·mol-1,计算每生产1
万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
18. (8分)二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
(8分)二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥-0.42 |
≥2.5 |
≥7 |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为__________________。
(2)滤渣A的主要成分为_________。
(3)加入MnS的目的是除去_________杂质。
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为__________________。
(5)从废旧碱性锌锰干电池中可以回收利用的物质有_________ (写出两种)。
17.(10分)已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答:
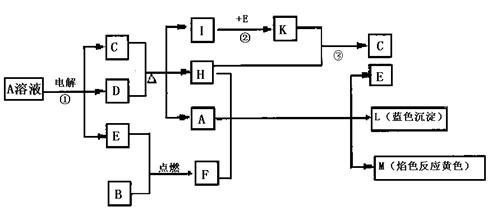
(1)写出化学式:A _________ ;E_________;L__________。
(2)反应①的离子方程式:____________________________________________ 。
(3)反应②,工业上采取的反应条件:______________________ 。
(4)反应③,工业上采取的操作不是K直接与H反应,原因是: 。
(5)每生成lmolK,反应放出98.3kJ热,该反应的热化学方程式为:
____________________________________________________________。
16.(9分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl
的流程如下:
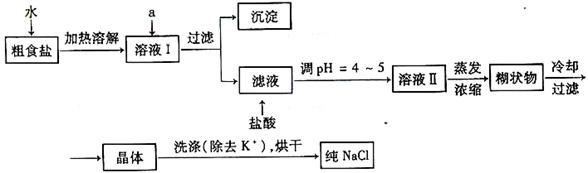
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液
Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 (只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 。
(2)用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还
有 (填仪器名称)。
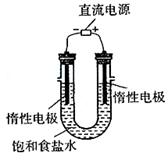 (3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2 (填“>”、
“=”或“<”=2L,原因是
。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2 (填“>”、
“=”或“<”=2L,原因是
。
装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为 。
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑;MnO2+4HCl
(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。可选用制备气体的装置:

13.电解100mL含c(H+)=0.30mol/L的下列溶液。当电路中通过0.04mol电子时,理论上析出金属质量最大的是
A.0.10mol/L Ag+ B.0.20mol/L Zn2+ C.0.20mol/L Cu2+ D.0.20mol/L Pb2+
第Ⅱ卷(55分)
12.下列叙述正确的是 ( )
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
11.用酸性氢氧燃料电池电解苦卤水(含Cl―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是 ( )
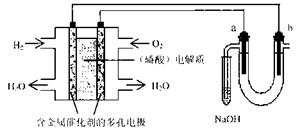
A.电池工作时,正极反应式为:O2 +2 H2O + 4e-=4 OH―
B.电解时,a 电极周围首先放电的是Br―而不是Cl―,说明当其它条件相同时前者的还原
性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02g H2 时,b 极周围会产生0.02g H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com