
题目列表(包括答案和解析)
21.(13分)下图是工业生产硝酸铵的流程。
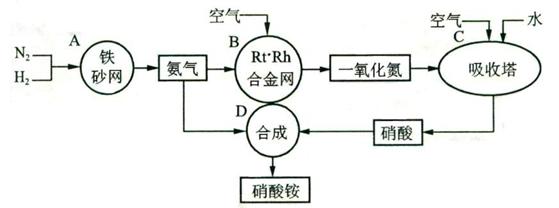
(1)吸收塔C中通人空气的目的是 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H=一1266.8kJ/mol
N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol
写出氨高温催化氧化的热化学方程式:
(3)已知:N2(g)+3H2(g) 2NH3(g);AH=一92kJ/mol。为提高氢气的转化率,宜采取的措施有
。(填字母)
2NH3(g);AH=一92kJ/mol。为提高氢气的转化率,宜采取的措施有
。(填字母)
A.升高温度 B.使用催化剂 C.增大压强 D.循环利用和不断补充氮气
E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡
时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为
20.(17分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
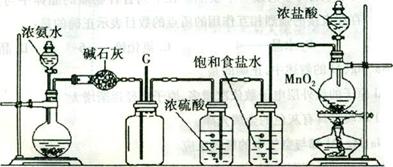
A B C D E F
请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A的烧瓶中可装试剂 。
(3)B装置的名称是 ;E装置的作用 。
(4)通人C装置的两根导管左边较长、右边较短,目的是 。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式: 。
当有n mol氯气参加反应时,转移的电子总数为b个,.贝mJN伏加德罗数常数为(用含a、b的代数式表示)
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
。
19.(12分)物质A、B、C、D等的转化关系如图所示。已知A是由两种元素组成的化合物,B是常见的气态单质,J是常见的金属单质,反应①是工业上制取K的第一步反应,反应②为化合反应。
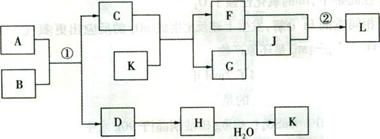
依据上述信息,回答下列的问题:
(1)J在元素周期表中的位置是 。
(2)F的水溶液显 (填“酸”、“碱”或“中”)性,用相关的离子方程式表示
。
(3)反应①的化学方程式为 。工业上反应①在 (填工业设备名称)中进行。
(4)反应②的离子方程式为 。
18.(6分)常温下,某水溶液M中存在的离子有:Na+、A一、H+、OH一。根据题意回答下列问题:
(1)若溶液M由0.1mo1/L的HA溶液与0.1mol/L的NaOH溶液等体积混合而得,则溶液M的pH不可能 7(填“大于”、“小于”或“等于”).
(2)若溶液M的pH>7,则c(Na+) c(A一)(填“>”、“<”或“=”).
(3)常温下,若溶液M由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2mL混合反应而得,则下列说法中正确的是 (填字母).
A.若溶液M呈中性,则溶液M中c(H+)+c(OH一)=2×10-7mol/L
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
17.(12分)下表是元素周期表的一部分。
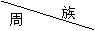 |
I A |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
|
一 |
|
|
|||||
|
二 |
a |
|
|
b |
d |
|
e |
|
三 |
|
f |
g |
|
|
h |
J |
(1)表中元素的单质中熔点最高的可能是 (填元素符号);写出a的氯化物的电子式 ;e、f、h形成的简单离子的半径由大到小顺序依次为
(填离子符号)。
(2)在一定条件下,j与d可形成一种化合物,常温下为淡黄色液体,则其晶体类型为
;该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种物质具有漂白性,写出相关反应的化学方程式 。
(3)在g的单质中添加f单质,形成物质k,则g、f、k中硬度最大的是 (填物质名称)。
16.可用右侧示意图表示的是
|
|
反应 |
纵坐标 |
甲 |
乙 |
|
A |
2molSO2与1 molO2,在相同温 度下2SO2+O2  SO3 SO3 |
SO3的物 质的量 |
l0个大 气压 |
2个大气 压 |
|
B |
相同质量氨气,在同一容器中 2NH3  N2+3H2;△H>0 N2+3H2;△H>0 |
氨气的 转化率 |
400℃ |
500℃ |
|
C |
体积比1:3的N2、H2,在体积可变的恒压容器中N2+3H2 2NH3; 2NH3; |
氨气的浓度 |
活性高的 催化剂 |
活性一般 的催化剂 |
|
D |
等质量钾、钠分别与水反应 |
H2质量 |
钠 |
钾 |
化 学 试 题
得分栏
选择题答案栏
第Ⅱ卷(非选择题共60分)
15.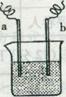 右图中,两电极上发生的电极反应为:
右图中,两电极上发生的电极反应为:
a极:Cu2++2e一=Cu b极:Fe一2e一=Fe2+
下列说法中不正确的是
A.该装置可能是电解池
B.a极上一定发生还原反应
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
14.将5.4gA1投入200.0mL 2.0mol/L的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
13.下列有关化学实验基本操作的叙述,正确的是
A为防止药品污染,实验结束后,用剩的白磷可溶解于CS2后倒人垃圾箱
B.除去淀粉溶液中混有的Na2SO4可以用渗析的方法
C.用玻璃棒蘸取待测液后,点在用蒸馏水润湿的pH试纸上,观察颜色变化并与标准比色卡比较测得该溶液的pH
D.酸碱中和滴定实验中,滴定时眼睛注视滴定管内液面的变化
12.下列溶液中各微粒的浓度关系正确的是
A.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):
c(NH4)2SO4>c(NH4HSO4)>c(NH4C1)
B.向醋酸钠溶液中加入适量醋酸,得到酸性混合溶液:
c(Na+)>c(CH3COO一)>c(H+)>c(OH一)
C.pH=6的纯水:c(H+)>c(OH一)
D.1.0mol/LNa2CO3溶液:c(OH一)=c(H+)+c(H2CO3)+c(HCO3-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com